Физико-химические свойства природного газа: Сухой газ – LNGas.ru
Природный газ в основном состоит из метана с примесью других углеводородов и инертных газов. Примерный состав природного горючего газа может характеризоваться следующими значениями (% по объему): метан – 85-99; этан – 1,0-8,0; пропан, бутан – 0,5-3,0; азот – 0,5-0,7; углекислота – до 1,8. Природный газ месторождений характеризуется различным составом. В зависимости от состава изменяются и его теплотехнические характеристики.
Для транспортировки по стандартным магистральным трубопроводам в России природный газ должен соответствовать следующим условиям, согласно ГОСТ 5542-87 (Газы горючие природные для промышленного и коммунально-бытового назначения): точка росы по воде и углеводородам –16°C летом и –20°C зимой при давлении 7,5 МПа (стандартное давление на входе магистрального трубопровода). Газ, соответствующий условиям на транспортировку трубопроводным транспортом, называют сухим. Основные компоненты сухого газа – метан и этан. Содержание углеводородов ряда С3-С5 ограничено вышеуказанными условиями по точке росы. Допускается содержание CO2 и инертных газов.
Основные компоненты сухого газа – метан и этан. Содержание углеводородов ряда С3-С5 ограничено вышеуказанными условиями по точке росы. Допускается содержание CO2 и инертных газов.
Приведем некоторые дополнительные показатели качества сухого газа по ГОСТ 5542-87. Низшая теплота сгорания составляет 8700 ккал/нм3. Обозначение нм3 относится к газу в нормальных условиях (нормальный кубический метр): это количество газа, находящегося в 1 куб. м при давлении в 1 атмосферу и температуре 0°С. Заметим, что в газовой промышленности применяется также обозначение SCM (стандартный кубический метр), отвечающий давлению в 1 атмосферу и температуре 21°С. Для него низшая теплота сгорания 8600 ккал/SCM. Массовая концентрация сероводорода допускается не более 0,02 г/SCM, массовая концентрация меркаптановой серы – не более 0,036 г/SCM, объемная доля кислорода – не более 1%, масса механических примесей не более 0,001 г/SCM.
Физико-химические свойства сжиженного природного газа (СПГ)
Одна из основных страниц сайта уже содержит основные свойства сжиженного природного газа. В качестве дополнения здесь приводится некоторая более детальная информация. Напомним, что СПГ – это криогенная жидкость, являющаяся смесью углеводородов ряда С1-С4 с содержанием метана более 80%. Количество углеводородов ряда С5-С8 в составе сжиженного природного газа допустимо, но ограничено долями процента и должно контролироваться, так как их повышенное содержание будет приводить к запарафиниванию поверхности криогенных технологических узлов.
| Компонентный состав сжиженного природного газа | ||||
| Источник: dolgikh.com | ||||
| Показатель | Норма, % | |||
| Объемная доля метана | 92±6 | |||
| Объемная доля этана | 4±3 | |||
| Объемная доля пропана и более тяжелых углеводородов | 2,5±2,5 | |||
| Объемная доля азота | 1,5±1,5 | |||
| Массовая доля сероводорода и меркаптановой серы | не более 0,005 | |||
| Типичный состав СПГ различных производителей | ||||||
| Источник: Oil&Gas Journal | ||||||
| Производители СПГ | Мольные доли фракций, % | |||||
| Метан | Этан | Пропан | Бутаны | Пентаны | ||
| Das Island, Абу Даби | 87,10 | 11,40 | 1,27 | 0,14 | 0,00 | |
| Whintnell Bay, Австралия | 87,80 | 8,30 | 2,98 | 0,88 | 0,00 | |
| Bintulu, Малайзия | 91,20 | 4,28 | 2,87 | 1,36 | 0,01 | |
| Arun, Индонезия | 89,20 | 8,58 | 1,67 | 0,51 | 0,02 | |
| Lumut, Бруней | 89,40 | 6,30 | 2,80 | 1,30 | 0,00 | |
| Bontang, Индонезия | 90,60 | 6,00 | 2,48 | 0,82 | 0,01 | |
| Ras Laffan, Катар | 89,60 | 6,25 | 2,19 | 1,07 | 0,04 | |
Физические свойства СПГ
Физические свойства сжиженного природного газа зависят от компонентного состава и от давления. Например, для плотности в различных источниках указываются следующие диапазоны значений: 370-430, 430-470, 410-500, 400-420 кг/м3. В нижеследующей таблице отражены изменения плотности и температуры кипения СПГ в зависимости от различных значений избыточного давления и компонентного состава газа.
Например, для плотности в различных источниках указываются следующие диапазоны значений: 370-430, 430-470, 410-500, 400-420 кг/м3. В нижеследующей таблице отражены изменения плотности и температуры кипения СПГ в зависимости от различных значений избыточного давления и компонентного состава газа.
| Зависимость плотности и температуры кипения СПГ от состава газа и избыточного давления | ||||
| Источник: dolgikh.com | ||||
| Давление, МПа | Состав, % метана | Молекулярная масса, кг/кг·моль | Плотность, кг/м куб. | Температура кипения, °C |
| 0,5 | 97 | 16,7 | 392 | –135 |
| 80 | 20,9 | 459 | –132 | |
| 0,0 | 97 | 16,7 | 422 | –162 |
| 80 | 20,9 | 495 | –160 | |
Основные физические характеристики сжиженного газа
- Температура кипения при атмосферном давлении: –162°C
- Плотность сжиженного газа при атмосферном давлении: 420 кг/м3
- Низшая теплота сгорания (при 0°C и 101,325 КПа): 35,2 МДж/м3(или 11500 ккал/кг)
- Пределы воспламенения при газификации: 4…16% (объемных)
- Минимальная температура воспламенения газовоздушной смеси: 557°C (830 К)
В процессе регазификации СПГ из одного объема жидкости при стандартных условиях (21°C, 1 атмосфера) получается около 618 объемов природного газа. Жидкий газ обычно хранится в изотермических резервуарах при температуре кипения, которая поддерживается за счет испарения СПГ.
Жидкий газ обычно хранится в изотермических резервуарах при температуре кипения, которая поддерживается за счет испарения СПГ.
При сжижении природного газа повышается как калорийность газа, получаемого последующей регазификацией, так и самого СПГ. С одной стороны, в процессе сжижения удаляется углекислый газ, а с другой – ШФЛУ, входящая в состав СПГ, повышает калорийность, так как этан, пропан и бутаны обладают большей высшей теплотой сгорания (высшей удельной теплотворной способностью), чем метан (на кубометр газа или на кубометр СПГ; если сравнивать по весу, то выигрыш незначителен). Этот аспект можно учесть, проводя экономические расчеты за поставляемый СПГ на калориметрической основе (а не на волюметрической). Для примера, расчеты показывают, что энергетическая ценность СПГ, получаемого из газа нижнего мела месторождений полуострова Ямал, может достигать 23 MBTU/м3 (24,5 ГДж/м3), что на 10% больше, чем для СПГ, получаемого из сухого газа.
Примечание:
Высшая теплотворная способность газа в жидком виде при 15°C:
- Метан – 16,672 ГДж/м3 (рассчитано условно как для идеального газа)
- Этан – 18,459 ГДж/м3
- Пропан – 25,358 ГДж/м3
- n-бутан –28,715 ГДж/м3)
Состав и физико-химические свойства природных газов
Природные газы – это вещества, которые при нормальных условиях находятся в газообразном состоянии.
Углеводородные газы, в зависимости от их состава, давления и температуры могут находиться в залежи в различных состояниях – газообразном, жидком или в виде газожидкостных смесей. Газ обычно расположен в газовой шапке в повышенной части пласта.
Если газовая шапка в нефтяной залежи отсутствует (это возможно при высоком пластовом давлении или особом строении залежи), то весь газ залежи растворён в нефти. Этот газ будет, по мере снижения давления, выделятся из нефти при разработке месторождения и будет называться попутным газом.
В пластовых условиях все нефти содержат растворённый газ. Чем выше давление в пласте, тем больше растворённого газа в
Давление, при котором весь имеющийся в залежи газ растворён в нефти, называется давлением насыщения. Оно определяется составом нефти и газа и температурой в пласте.
От давления насыщения зависит газовый фактор – количество газа (в м3), содержащееся в 1 тонне нефти.
Газы могут находиться в пласте в трёх состояниях: свободном, сорбированном, растворённом.
3.1.1. Состав природных газов
Природные газы, добываемые из газовых, газоконденсатных и нефтяных месторождений, состоят из углеводородов (СН4 – С4Н10, для Н.У. и С.У.), а также неуглеводородных компонентов (h3S, N2, CO, CO2, Ar, h3, He).
При нормальных и стандартных условиях в газообразном состоянии существуют только углеводороды С1–С4. Углеводороды С5 и выше в нормальных условиях находятся в жидком состоянии.
Газы, добываемые из чисто газовых месторождений, содержат более 95% метана (табл. 3.1).
Химический состав газа газовых месторождений, об. %
Таблица 3.1
|
Месторождение |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
N2 |
СО2 |
Относит. |
|
Северо-Ставропольское |
98,9 |
0,29 |
0,16 |
0,05 |
– |
0,4 |
0,2 |
0,56 |
|
Уренгойское |
98,84 |
0,1 |
0,03 |
0,02 |
0,01 |
1,7 |
0,3 |
0,56 |
|
Шатлыкское |
95,58 |
1,99 |
0,35 |
0,1 |
0,05 |
0,78 |
1,15 |
0,58 |
|
Медвежье |
98,78 |
0,1 |
0,02 |
– |
– |
1,0 |
0,1 |
0,56 |
Содержание метана на газоконденсатных месторождениях – 75-95% (табл. 3.2).
3.2).
Химический состав газа газоконденсатных месторождений, об. %
Таблица 3.2
|
Месторождение |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
N2 |
СО2 |
Относит. плотность |
|
Вуктыльское |
74,80 |
7,70 |
3,90 |
1,80 |
6,40 |
4,30 |
0,10 |
0,882 |
|
Оренбургское |
84,00 |
5,00 |
1,60 |
0,70 |
1,80 |
3,5 |
0,5 |
0,680 |
|
Ямбургское |
89,67 |
4,39 |
1,64 |
0,74 |
2,36 |
0,26 |
0,94 |
0,713 |
|
Уренгойское |
88,28 |
5,29 |
2,42 |
1,00 |
2,52 |
0,48 |
0,01 |
0,707 |
Газы, добываемые вместе с нефтью (попутный газ) представляют собой смесь метана, этана, пропан-бутановой фракции (сжиженного газа) и газового бензина. Содержание метана – около 35-85%. Содержание тяжёлых углеводородов в попутном газе 20-40% , реже – до 60% (табл. 3.3).
Содержание метана – около 35-85%. Содержание тяжёлых углеводородов в попутном газе 20-40% , реже – до 60% (табл. 3.3).
Химический состав газа нефтяных месторождений (попутного газа), об. %
Таблица 3.3
|
Месторождение |
СН4 |
С2Н6 |
С3Н8 |
С4Н10 |
С5Н12 |
N2 |
СО2 |
Относит. плотность |
|
Бавлинское |
35,0 |
20,7 |
19,9 |
9,8 |
5,8 |
8,4 |
0,4 |
1,181 |
|
Ромашкинское |
3838 |
19,1 |
17,8 |
8,0 |
6,8 |
8,0 |
1,5 |
1,125 |
|
Самотлорское |
53,4 |
7,2 |
15,1 |
8,3 |
6,3 |
9,6 |
0,1 |
1,010 |
|
Узеньское |
50,2 |
20,2 |
16,8 |
7,7 |
3,0 |
2,3 |
– |
1,010 |
Тяжёлым нефтям свойственны сухие нефтяные газы (с преобладанием метана).
(3.1)
Под тяжелыми УВ понимаются углеводороды от этана (С2Н6) и выше.
Лёгким нефтям свойственны жирные газы:
(3.2)
3.1.2. Физико-химические свойства углеводородных газов
Нефтяной газ при нормальных условиях содержит неполярные углеводороды (смесь компонентов от С1 до С4), и с точки зрения физики к ним можно применять законы для идеальных систем. С точки зрения математики – это аддитивная система. Следовательно, к нему при нормальных условиях применимы аддитивные методы расчётов физико-химических и технологических параметров (Псмеси):
, (3.3)
где gi – весовая доля;
Ni – мольная доля;
Vi – объёмная доля;
Пi – параметр i-го компонента.
Плотность смеси газов рассчитывается следующим образом:
. (3.4)
При нормальных условиях плотность газа rг = Mi / 22,414.
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать, как выражается состав смеси.
Массовая доля (gi) – отношение массы i-го компонента, содержащегося в системе к общей массе системы:
(3.5)
Молярная (мольная) доля (Ni) – отношение числа молей i-го компонента к общему числу молей в системе:
(3.6)
, (3.7)
где mi – масса i-го компонента;
Мi – молекулярный вес.
(3.8)
Объёмная доля (Vi) – доля, которую занимает компонент в объёме системы.
(3.9)
Для идеального газа соблюдается соотношение Vi = Ni .
Молекулярная масса смеси рассчитывается следующим образом:
(3.10)
Относительная плотность газа по воздуху:
. (3.11)
Для нормальных условий ρвозд » 1,293; для стандартных условий ρвозд » 1,205.
Если плотность газа задана при атмосферном давлении (0,1013 МПа), то пересчёт её на другое давление (при той же температуре) для идеального газа производится по формуле:
. (3.12)
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов.
Для идеальных газов давление смеси равно сумме парциальных давлений компонентов (закон Дальтона):
, (3.13)
где Р – давление смеси газов;
рi – парциальное давление i-го компонента в смеси,
или
. (3.14)
. (3.15)
Т. е. парциальное давление газа в смеси равно произведению его молярной доли в смеси на общее давление смеси газов.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага:
, (3.16)
где V – объём смеси газов;
Vi – объём i-го компонента в смеси.
или
. (3.17)
(3.17)
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используется давление, температура, объём.
Состояние газа при стандартных условиях характеризуется уравнением состояния Менделеева-Клайперона:
, (3.18)
где Р – абсолютное давление, Па;
V – объём, м3;
Q – количество вещества, кмоль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная Па×м3/(кмоль×град).
У этого уравнения есть свои граничные условия. Оно справедливо для идеальных газов при нормальном (1 атм.) и близких к нормальному давлениях (10-12 атм.).
При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу.
Для учёта этого взаимодействия в уравнение (3.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения реального газа от идеального состояния:
, (3.19)
где Q – количество вещества, моль.
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Клайперона-Менделеева для высоких давлений.
Коэффициент z зависит от давления и температуры, природы газа (критических давлений и температуры).
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние.
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа отклоняются от критических:
(3. 20)
20)
(3.21)
z = f ( Тприв, Рприв) (3.22)
Существуют графики, эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
Зная коэффициент сверхсжимаемости, можно найти объём газа в пластовых условиях по закону Бойля-Мариотта:
. (3.23)
Объёмный коэффициент газа используется при пересчёте объёма газа в нормальных условиях на пластовые условия и наоборот (например, при подсчёте запасов):
(3.24)
Вязкость газа – свойство газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкость m и кинематическую вязкость n. Кинематическая вязкость учитывает влияние силы тяжести.
Динамическая вязкость зависит от средней длины пробега молекул газа и от средней скорости движения молекул газа:
, (3. 25)
25)
где r – плотность газа;
– средняя длина пробега молекулы;
– средняя скорость молекул.
Кинематическая вязкость природного газа при нормальных условиях невелика и не превышает 0,01 сантипуаза.
Динамическая вязкость газа увеличивается с ростом температуры (при повышении температуры увеличивается средняя скорость и длина пробега молекул), однако при давлении более 3 МПа вязкость с ростом температуры начинает снижаться. От давления вязкость газа практически не зависит (снижение скорости и длины пробега молекул при увеличении давления компенсируется ростом плотности).
состав и свойства природного газа, добыча и сфера его применения
Благодаря высокой энергоэффективности и экологичности природный газ, наряду с нефтью, имеет первостепенное значение. Он широко используется в качестве топлива, а также служит ценным сырьем для химической промышленности.
И хотя использование газа стало повседневным и привычным, он все также остается непростым по составу и довольно опасным веществом – чтобы попасть в горелку газового прибора оно проходит длинный и сложный путь.
В статье мы разберем основные вопросы, связанные с природным горючим газом – поговорим о его составе и свойствах, опишем этапы добычи, транспортировки и переработки газа, сферы его применения. Рассмотрим современные представления о происхождении запасов углеводородов, интересные факты и гипотезы.
Содержание статьи:
Что такое природный горючий газ?
Бытует мнение, что газ залегает под землей в пустотах и легко оттуда извлекается, для чего достаточно пробурить скважину. Но в реальности все намного сложнее: газ может находиться внутри пористой породы, может быть растворен в воде, жидких углеводородах, нефти.
Чтобы понять, почему это происходит, достаточно вспомнить, что слово «газ» происходит от греческого «хаос», которое отражает принцип поведения вещества. В газообразном состоянии молекулы движутся хаотически, стремясь равномерно заполнить весь возможный объем. За счет этого они способны проникать и растворяться в других веществах, в том числе и более плотных жидкостях и минералах. Высокое давление и температура значительно усиливают процесс диффузии. Часто именно в виде такого «коктейля» природный газ содержится в недрах.
Высокое давление и температура значительно усиливают процесс диффузии. Часто именно в виде такого «коктейля» природный газ содержится в недрах.
Но для начала поговорим о том, из чего состоит газ и что он из себя представляет – рассмотрим химический состав и физические свойства природного горючего газа.
Особенности химического состава
Газ, добываемый из недр, который называют «природным», – это смесь различных газов.
По составу он делится на три группы компонентов:
- горючие – углеводороды;
- негорючие (балласты) – азот, углекислый газ, кислород, гелий, пары воды;
- вредные примеси – сероводород и меркаптаны.
Первая и главная группа представляет собой набор углеводородов метанового ряда (гомологов) с количеством атомов углерода от 1 до 5. Наибольший процент в смеси составляет метан (от 70 до 98 %), имеющий один атом углерода. Содержание остальных газов (этана, пропана, бутана, пентана) колеблется от единиц до десятых долей процента.
Для газа, добываемого из месторождений, характерна высокая концентрация метана. В попутном, извлекаемого из нефти, доля метана намного ниже: 30 – 60%, а гомологов выше: 10 – 20 %
Кроме углеводородов в смеси могут присутствовать негорючие вещества в небольших количествах: сероводород, азот, углекислый газ, оксид углерода, водород и другие. Но, в зависимости от месторождения, пропорции углеводородов, как и состав других газов, могут значительно колебаться.
Физические свойства газа
По физическим свойствам метан СН4не имеет цвета и запаха, очень горюч. При концентрациях в воздухе более 4,5% – взрывоопасен. Это его свойство, в сочетании с отсутствием запаха, представляет большую угрозу и проблему. Особенно в шахтах, так как метан абсорбируется углем.
О причинах взрыва газа в бытовых условиях мы писали в .
Для придания газу запаха, с целью обнаружения его утечек, перед транспортировкой в него добавляют специальные вещества с неприятным запахом – одоранты. Чаще всего, это серосодержащие соединения – этантиол или этилмеркаптан. Долю примеси подбирают таким образом, чтобы была ощутима утечка при концентрации газа в 1%.
Чаще всего, это серосодержащие соединения – этантиол или этилмеркаптан. Долю примеси подбирают таким образом, чтобы была ощутима утечка при концентрации газа в 1%.
Главным преимуществом голубого топлива является высокая удельная теплота сгорания – 39 МДж/кг. При этом выделяются безвредные вещества: вода и углекислый газ. Это также немаловажный фактор, позволяющий применять метан в быту
Откуда берется газ в недрах земли?
Хотя люди научились применять газ более 200 лет назад, до настоящего времени нет единого мнения, откуда берется газ в недрах земли.
Основные теории происхождения
Существуют две основные теории его происхождения:
- минеральная, объясняющая образование газа процессами дегазации углеводородов из более глубоких и плотных слоев земли и поднятием их в зоны с меньшим давлением;
- органическая (биогенная), согласно которой газ – это продукт разложения остатков живых организмов в условиях повышенного давления, температуры и отсутствия воздуха.

В месторождении газ может находиться в виде отдельного скопления, газовой шапки, раствора в нефти или воде, либо газогидратов. В последнем случае залежи находятся в пористых породах между газонепроницаемыми пластами глины. Чаще всего такими породами являются уплотненный песчаник, карбонаты, известняки.
Доля обычных газовых месторождений составляет всего 0,8%. Немного больший процент приходится на глубинный, угольный и сланцевый газ – от 1, 4 до 1,9 %. Наиболее распространенными видами залежей являются водорастворенные газы и гидраты – приблизительно в равных пропорциях (по 46,9%)
Поскольку газ легче нефти, а вода тяжелее, положение ископаемых в пласте всегда одинаковое: газ сверху нефти, а вода подпирает снизу все нефтегазовое месторождение.
Газ в пласте находится под давлением. Чем глубже залежи, тем оно выше. В среднем, на каждые 10 метров, прирост давления составляет 0,1 МПа. Существуют пласты с аномально высоким давлением. Например, на Ачимовских отложениях Уренгойского месторождения оно достигает 600 атмосфер и выше при глубине залегания от 3800 до 4500 м.
Интересные факты и гипотезы
Еще не так давно считалось, что мировые запасы нефти и газа должны исчерпаться уже в начале XXI века. Например, об этом писал в 1965 году авторитетный американский геофизик Хабберт.
До настоящего времени многие страны продолжают наращивать темпы добычи газа. Никаких реальных признаков, что запасы углеводородов заканчиваются, не наблюдается
По мнению доктора геолого-минералогических наук В.В. Полеванова, подобные заблуждения вызваны тем, что теория органического происхождения нефти и газа до сих пор общепринята и владеет умами большинства ученых. Хотя еще Д.И. Менделеев обосновал теорию о неорганическом глубинном происхождении нефти, а затем это было доказано Кудрявцевым и В.Р. Лариным.
Но против органического происхождения углеводородов говорят многие факты.
Вот некоторые из них:
- открыты месторождения на глубинах до 11 км, в кристаллических фундаментах, где существование органики не может быть даже теоретически;
- с помощью органической теории можно объяснить только 10 % запасов углеводородов, остальные 90% необъяснимы;
- космический зонд «Кассини» обнаружил в 2000 году на спутнике Сатурна Титане гигантские ресурсы углеводорода в виде озер, на несколько порядков превышающих земные.

Выдвинутая Лариным гипотеза изначально гидридной Земли объясняет происхождение углеводородов путем реакции водорода с углеродом в глубинах земли и последующей дегазацией метана.
Согласно ей, нет никаких древних залежей юрского периода. Вся нефть и газ могли образоваться в пределах от 1 до 15 тысяч лет назад. По мере отбора запасы могут постепенно пополнятся, что замечено на давно выработанных и заброшенных нефтяных месторождениях.
Как происходит добыча и транспортировка?
Процесс добычи природного горючего газа начинается со строительства скважин. В зависимости от залегания газоносного пласта их глубина может достигать 7 км. По мере бурения в скважину опускается труба (обсадная колонна). Для предотвращения выхода газа через пространство между трубой и стенками скважины делается тампонаж – заполнение зазора глиной либо цементом.
По окончанию строительства буровая вышка убирается и на головку обсадной колонны устанавливается фонтанная арматура. Она представляет собой конструкцию из задвижек и клапанов, служит для отбора газа из скважины.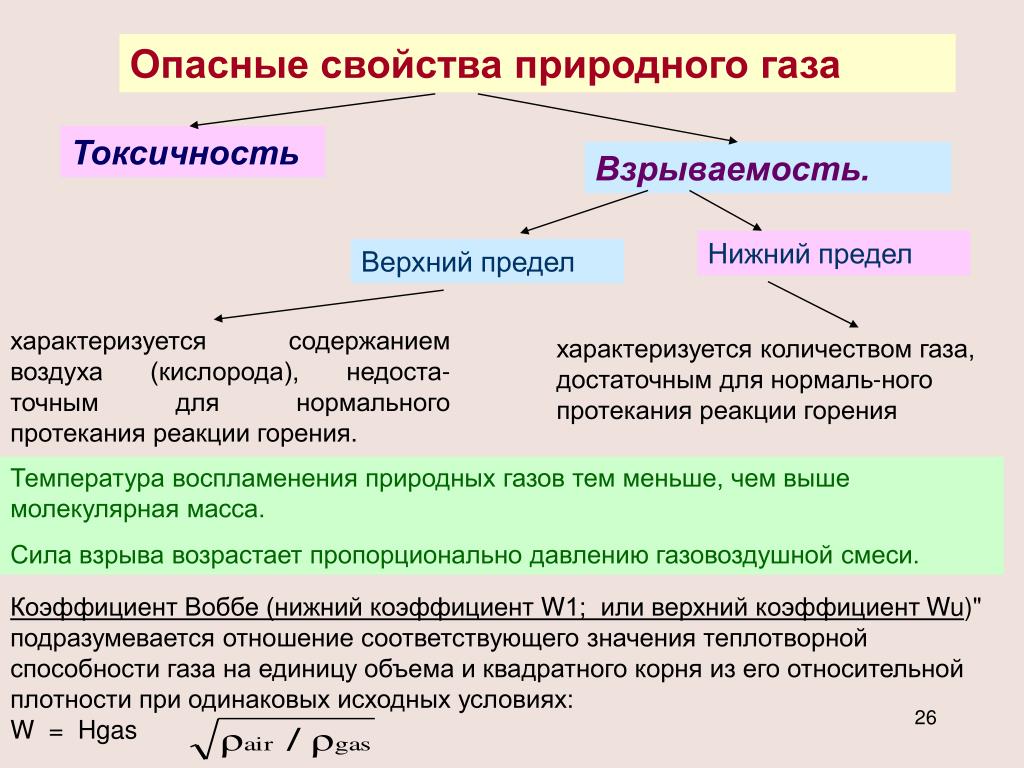
Количество скважин может быть достаточно большим.
На фонтанную арматуру возлагается несколько функций: она удерживает в подвешенном состоянии в скважине насосно-компрессорные трубы, управляет рабочими режимами, измеряет параметры внешней и внутренней части скважины
Весь цикл добычи природного горючего газа происходит в три этапа:
- Разработка газового месторождения. В результате бурения создается разность давлений. За счет этого газ движется по пласту к скважинам.
- Эксплуатация газовых скважин. На этом этапе газ проходит путь по обсадной колонне.
- Сбор и подготовка к транспортировке. Газ из всех фонтанных арматур поступает на специальные технологические комплексы УКПГ. На них происходит осушка газа, от вредных примесей.
Даже незначительные концентрации сероводорода, водяного пара или твердых частиц приводят к быстрой коррозии, образованию гидрата и механическим повреждениям внутренней поверхности трубопровода.
Окончательная подготовка к транспортировке происходит на головных сооружениях. Она включает в себя доочистку и удаление углеводородного конденсата, охлаждение газа для уменьшения его объема.
Основным видом транспортировки газа на большие расстояния является . Он представляет собой систему сложных инженерных сооружений от самих трубопроводов до .
В конечном пункте магистрали находятся газораспределительные станции (ГРС). Здесь происходит последняя очистка от примесей пыли и жидкостей, понижение давления до уровня, необходимого потребителям, его стабилизация, учет расхода газа и добавление одоранта.
Другим распространенным видом транспортировки метана являются морские перевозки специальными судами – газовозами.
Огромные шарообразные резервуары не позволят спутать газовоз с другими типами судов. Они представляют собой термосы поддерживающие постоянную необходимую температуру для жидкого метана -163 °С
Превращение газа в жидкое состояние производится на специальных заводах СПГ. Процесс происходит в два этапа: сначала метан охлаждается до -50 °С, а затем до -163 °С. При этом его объем уменьшается в 600 раз.
Процесс происходит в два этапа: сначала метан охлаждается до -50 °С, а затем до -163 °С. При этом его объем уменьшается в 600 раз.
Переработка и сфера применения
Высокая горючесть природного газа определяет его основное применение. Он используется в виде топлива на заводах, фабриках, ТЭЦ, котельных, учреждениях, в жилых домах, сельскохозяйственных объектах и многих других. Рекомендуем ознакомиться с правилами .
Добыча и переработка нефти всегда сопровождается выделением сопутствующего газа. В некоторых случаях его объемы могут быть внушительными и составлять до 300 кубометров на один куб сырой нефти.
Но существует большое количество месторождений, где природный попутный газ не используется, а сжигается в факелах. Например, по всей России таким образом теряется до 25% полезного сырья.
Часть попутного газа поступает на газоперерабатывающие заводы. Из него получают очищенный сухой газ, который используется для отопления. Другой ценной составляющей является смесь легких углеводородов.
На схеме показана общая картина процесса переработки добываемого газа. Роль конечных продуктов для современной химической промышленности трудно переоценить
Далее она разделяется на фракции в специальных установках. В результате получаются такие углеводороды как пропан, бутан, изобутан, пентан. Для уменьшения объема, удобства транспортировки и хранения их .
Переоборудование автомобилей на газ быстро окупается и дает ощутимую экономию средств. Расширение сети газовых заправок способствует увеличению парка авто с ГБО. Выигрывают не только водители, но и пешеходы, которым не приходится дышать вредными выхлопами
Пропан и бутан применяют для отопления домов либо для автомобилей. Но большая часть поступает на дальнейшую переработку на нефтехимические производства.
Путем высокотемпературного нагрева (пиролиза) из них получают главное сырье для всех синтетических материалов – мономеры: этилен, пропилен, бутадиен. Под действием катализаторов они соединяются в полимеры.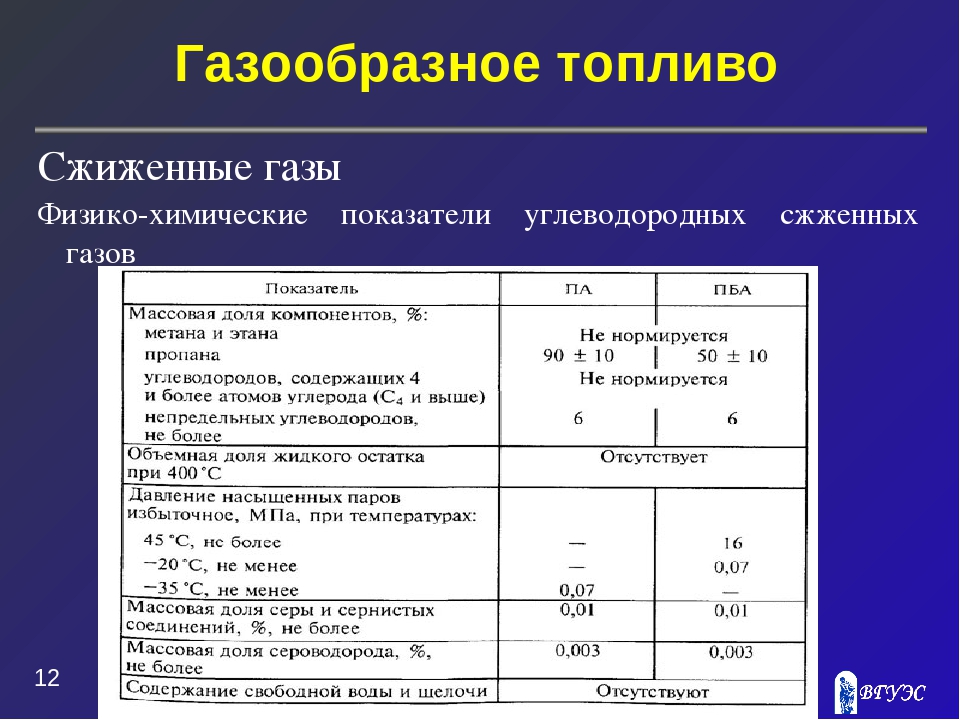 На выходе получаются такие ценнейшие материалы как каучук, ПВХ, полиэтилен и многие другие.
На выходе получаются такие ценнейшие материалы как каучук, ПВХ, полиэтилен и многие другие.
Выводы и полезное видео по теме
В документальный фильме доступно и наглядно рассказано о газе:
Этот учебный фильм посвящен магистральному транспорту газа:
Нам еще далеко не все известно о природном газе – его происхождение по-прежнему таит много загадок. Остается надеяться, что голубое топливо – действительно неисчерпаемый дар, которого хватит и нам, и нашим потомкам.
У вас остались вопросы после прочтения изложенного выше материала? Или хотите дополнить статью полезными замечаниями, интересными фактами или фотоснимками? Пишите свои комментарии, задавайте вопросы, участвуйте в обсуждении – форма обратной связи расположена ниже.
Природный газ состав. Свойства природного газа, опасности использования.

Определение
Природный газ – это полезное ископаемое в газообразном состоянии. Оно используется в очень широких пределах в качестве топлива. Но сам природный газ как таковой не используется как топливо, из него выделяют его составляющие для отдельного использования.
Состав природного газа
До 98% природного газа составляет метан, также в его состав входят гомологи метана — этан, пропан и бутан. Иногда могут присутствовать углекислый газ, сероводород и гелий. Таков состав природного газа.
Физические свойства
Природный газ бесцветен и не имеет запаха (в том случае, если не имеет в своём составе сероводорода), он легче воздуха. Горюч и взрывоопасен.
Ниже приведены более подробные свойства компонентов природного газа.
Свойства отдельных составляющих природного газа (рассмотрим подробный состав природного газа)
Метан (Ch5) – это бесцветный газ без запаха, легче воздуха. Горюч, но всё же его можно хранить с достаточной лёгкостью.
Этан (C2H6) – бесцветный газ без запаха и цвета, чуть тяжелее воздуха. Также горюч, но не используется как топливо.
Пропан (C3H8) – бесцветный газ без запаха, ядовит. У него имеется полезное свойство: пропан сжижается при небольшом давлении, что позволяет легко отделять его от примесей и транспортировать.
Бутан (C4h20) – по свойствам близок к пропану, но имеет более высокую плотность. Вдвое тяжелее воздуха.
Углекислый газ (CO2) – бесцветный газ без запаха, но с кислым вкусом. В отличие от других компонентов природного газа (за исключением гелия), углекислый газ не горит. Углекислый газ – один из самых малотоксичных газов.
Гелий (He) – бесцветный, очень лёгкий (второй из самых лёгкий газов, после водорода) без цвета и запаха. Крайне инертен, при нормальных условиях не реагирует ни с одним из веществ. Не горит. Не токсичен, но при повышенном давлении может вызывать наркоз, как и другие инертные газы.
Сероводород (h3S) – бесцветный тяжелый газ с запахом тухлых яиц. Очень ядовит, даже при очень маленькой концентрации вызывает паралич обонятельного нерва.
Очень ядовит, даже при очень маленькой концентрации вызывает паралич обонятельного нерва.
Свойства некоторых других газов, не входящих в состав природного газа, но имеющих применение, близкое к применению природного газа
Этилен (C2h5) – Бесцветный газ с приятным запахом. По свойствам близок к этану, но отличается от него меньшей плотностью и горючестью.
Ацетилен (C2h3) – чрезвычайно горючий и взрывоопасный бесцветный газ. При сильном сжатии способен взрываться. Он не используется в быту из-за очень большого риска пожара или взрыва. Основное применение – в сварочных работах.
Применение
Метан используется как горючее в газовых плитах.
Пропан и бутан – в качестве топлива в некоторых автомобилях. Также сжиженным пропаном заполняют зажигалки.
Этан в качестве горючего используют редко, основное его применение – получение этилена.
Этилен является одним из самых производимых органических веществ в мире. Он является сырьём для получения полиэтилена.
Он является сырьём для получения полиэтилена.
Ацетилен используется для создания очень высокой температуры в металлургии (сверка и резка металлов). Ацетилен очень горюч, поэтому в качестве топлива в автомобилях не используется, да и без этого условия его хранения должны строго соблюдаться.
Сероводород, несмотря на его токсичность, в малых количествах применяется в т.н. сероводородных ваннах. В них используются некоторые антисептические свойства сероводорода.
Основным полезным свойством гелия является его очень маленькая плотность (в 7 раз легче воздуха). Гелием заполняют аэростаты и дирижабли. Водород ещё более лёгок, чем гелий, но в то же время горюч. Большую популярность среди детей имеют воздушные шарики, надуваемые гелием.
Токсичность
Углекислый газ. Даже большие количества углекислого газа никак не влияют на здоровье человека. Однако он препятствует поглощению кислорода при содержании в атмосфере от 3% до 10% по объёму. При такой концентрации начинается удушье и даже смерть.
При такой концентрации начинается удушье и даже смерть.
Гелий. Гелий абсолютно нетоксичен при нормальных условиях из-за его инертности. Но при повышенном давлении возникает начальная стадия наркоза, похожая на воздействие веселящего газа*.
Сероводород. Токсичные свойства этого газа велики. При длительном воздействии на обоняние возникает головокружение, рвота. Также парализуется обонятельный нерв, поэтому возникает иллюзия отсутствия сероводорода, а на самом деле организм его уже просто не ощущает. Отравление сероводородом наступает при концентрации 0,2–0,3 мг/м3, концентрация выше 1 мг/м3 — смертельна.
Процесс горения
Все углеводороды при полном окислении (избыток кислорода) выделяют углекислый газ и воду. Например:
Ch5 + 3O2 = CO2 + 2h3O
При неполном (недостаток кислорода) — угарный газ и воду:
2Ch5 + 6O2 = 2CO + 4h3O
При ещё меньшем количестве кислорода выделяется мелкодисперсный углерод (сажа):
Ch5 + O2 = C + 2h3O.
Метан горит голубым пламенем, этан — почти бесцветным, как спирт, пропан и бутан — жёлтым, этилен — светящимся, угарный газ — светло-голубым. Ацетилен — желтоватым, сильно коптит. Если у Вас дома стоит газовая плита и вместо обычного голубого пламени вы видите жёлтое — знайте, это метан разбавляют пропаном.
Примечания
Гелий, в отличие от любого другого газа, не существует в твёрдом состоянии.
Веселящий газ – это тривиальное название закиси азота N2O.
Автор статьи: специалист alternativenergy.ru в области химии, пользователь ресурса — Ivan
Замечания и дополнения к статье — в комментарии.
Физико-химические свойства сжатого природного газа
Категория:
Газобалонное оборудование
Публикация:
Физико-химические свойства сжатого природного газа
Читать далее:
Физико-химические свойства сжатого природного газа
Уже отмечалось, что чистого метана в природных газах нет, в их составе другие углеводородные и инертные газы, но основной составляющей является метан, который практически и определяет свойства СПГ. По фи-зико-химическим характеристикам метан приближенно соответствует техническому, для которого и производится большинство расчетов по тепло-физическим свойствам для моторного топлива. Поэтому ниже и приведены характеристики автомобильной газовой аппаратуры и оборудования применительно к техническому метану. Из всех углеводородных газов он содержит максимум водорода на один атом углерода и поэтому обладает высокой теплотой сгорания, достаточно широкими пределами воспламенения, низким содержанием Т9ксических веществ (СО и СН) в продуктах сгорания. Метан намного легче воздуха (в отличие от других углеводородных газов), и поэтому при утечках он улетучивается, скапливаясь в верхних частях помещения. Метан имеет высокую детонационную стойкость, что обеспечивает «мягкую» работу двигателя. При дросселировании метана, например в газовом редукторе высокого давления, температура его резко снижается, что необходимо учитывать при эксплуатации автомобилей на СПГ.
Газ, подаваемый в магистральные газопроводы, должен соответствовать требованиям ГОСТ 5542—87 «Газы горючие природные для промышленного и коммунально-бытового назначения. Технические условия». Настоящий стандарт распространяется в основном на природные газы, предназначенные, в качестве топлива для коммунально-бытовых целей. Однако опыт эксплуатации газобаллонных автомобилей (ГБА) показывает, что удовлетворительные параметры по мощности, топливной экономичности и токсичности отработанных газов могут быть обеспечены только при строгой регламентации компонентного состава газа, поставляемого в качестве моторного топлива. С целью обеспечения гарантированных эксплуатационных качеств ГБА Мингазпромом СССР были разработаны технические условия ТУ 51.166—83 «Газ горючий природный сжатый, топливо для газобаллонных автомобилей».
Для заправки ГБА применяют две марки СПГ: А и Б. Хотя они и различаются компонентным составом, однако их свойства определяются основной составляющей этих газов — метаном. Теплофизические свойства природных газов марок А и Б в целом мало отличаются друг от друга, наоборот, они равноценны по эксплуатационным свойствам и сезону применения. Относительная плотность СПГ марок А и Б составляет 4%; по температуре воспламенения СПГ в 3 раза превышает бензин (в камере сгорания двигателя 635—645 °С). Такая высокая температура воспламенения СПГ затрудняет запуск двигателя, особенно в зимних условиях при пониженной температуре воздуха (менее —5 °С). Вместе с тем с точки зрения возможного воспламенения и пожароопасности СПГ значительно безопаснее бензина с СНГ.
Рекламные предложения на основе ваших интересов:
Рекламные предложения:
Читать далее: Основные теплофизические свойства природного газа
Категория: — Газобалонное оборудование
Главная → Справочник → Статьи → Форум
Химические и физические свойства природных газов
ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ПРИРОДНЫХ ГАЗОВ [c.33]Газовая печная среда, образующаяся при горении природного газа в рабочей камере печи, имеет высокое парциальное давление водяных паров. Химический ее состав, температура и давление зависят от режима сжигания. При неконтролируемой среде возможно протекание ряда сопутствующих физических и химических процессов, которые отрицательно влияют на качество получаемых продуктов. Например, ири выплавке алюминия и его сплавов происходит насыщение расплава газами, которое ведет к образованию газовых раковин, резко выраженной пористости, появлению неметаллических включений, являющихся концентраторами напряжения, снижающими прочность и предел усталости, к снижению пластических свойств металла, к образованию дефектов типа окисных плен, име ющих большую твердость и нулевую пластичность, к появлению пузырей при окончательной термообработке готовых изделий, что ухудшает механические свойства при закалке и старении сплавов. [c.76]
Авторы не ставили целью дать исчерпывающее описание всех физических и химических характеристик природных газов и их компонентов. Основное внимание они уделили параметрам, играющим существенную роль при выборе заменяющего или дополняющего природный газ источника. Рассмотрим основные характеристики газа и их,значимость при производстве ЗПГ и обеспечении требуемых свойств. [c.34]
Так как состав и физические свойства газов как чисто газовых, так и нефтяных месторождений близки (особенно после отделения высокомолекулярных углеводородов), все газы рассмотренной группы обычно называют природными. Как было указано, эти газы во все возрастающем объеме используются в качестве сырья для химической промышленности, но большая часть их находит применение в качестве технологического или энергетического топлива. [c.17]
Физикохимия и физикохимическая технология нефти немыслимы без информации о ее физических и химических свойствах и об их термобарических закономерностях. Сведения о качестве, характеризующиеся совокупностью физических свойств, необходимы для проведения научных исследований, инженерных расчетов и проектирования технологических процессов добычи, транспортирования, хранения и переработки нефти и природного газа. Сведения о физических свойствах углеводородного сырья принято представлять преимущественно в виде таблиц, номограмм в справочной литературе, а также эмпирических формул, обладающих не всегда высокой адекватностью. [c.69]
Современная химическая технология изучает производства самых различных веществ продуктов переработки нефти, каменного угля и природного газа, органических и неорганических веществ, полимерных и других материалов. В перечисленных и многих других технологиях, помимо собственно химических превращений, используются типовые процессы перемещения жидкостей и газов (паров), разделения гетерогенных смесей, нагревания и охлаждения, концентрирования растворов твердых веществ, разделения газовых (паровых) и жидких смесей, обезвоживания капиллярно-пористых материалов, растворения, кристаллизации и др. Все эти процессы имеют одинаковую физическую и физико-химическую основу независимо от свойств взаимодействующих веществ, поэтому методы анализа и расчетов и аппаратурное оформление также оказываются одинаковыми. [c.9]
Все продукты, методы анализа которых рассмотрены в главе, условно разделены на 5 групп. Основными признаками отнесения продуктов к той или иной группе служили их физическое состояние, вязкость и летучесть. В первую группу (анализ топлив) включены методы анализа природных газов, бензинов, авиационных газотурбинных топлив и автотракторных дизельных топлив, а также товарных и промежуточных продуктов соответствующих фракций нефтей и других органических продуктов. Сырые нефти, вакуумные газойли, тяжелые моторные и котельные топлива, присадки к маслам, мазуты и битумы по своим физико-химическим свойствам и методам анализа ближе к смазочным маслам, поэтому их анализ рассмотрен в следующем параграфе. В третью группу продуктов входят консистентные смазки и отложения. Под термином отложения подразумевается группа веществ, выделяющихся по разным причинам из нефти и нефтепродуктов в процессе их добычи, переработки, хранения и применения. В четвертую группу объединены высокомолекулярные полимеры, которые при комнатной температуре представляют собой твердое вещество. Для анализа низкомолекулярных, жидких полимеров следует пользоваться методами анализа масел. Наконец, в пятой группе рассматриваются методы анализа нефтяных коксов и углей. [c.161]
Природные и нефтяные газы — это источники ценного углеводородного сырья для нефтехимической и химической промышленности. Основной компонент этих газов — метан, по физическим свойствам он резко отличается от других компонентов газа. На различии физических констант компонентов основаны процессы, применяемые для извлечения из газа целевых компонентов и их разделения. [c.212]
При химической обработке стали состав и ее физические свойства изменяются только в поверхностном слое, а внутренняя часть изделия остается достаточно пластичной. Для придания твердости и износостойкости поверхности стали ее подвергают цементации или азотированию. Цементацией называется насыщение поверхностного слоя стали углеродом с образованием цементита. Оно проводится путем нагревания готовых изделий в атмосфере метана (природного газа), а также в твердых смесях, в состав которых входят древесный уголь, сода и поташ. Азотированием называется насыщение стали азотом, который с железом и легирующими элементами дает твердые нитриды. Для этого стальные изделия нагревают в атмосфере аммиака при 500—600° С. Тогда азот, образующийся в результа- [c.171]
При химической обработке стали состав и ее физические свойства изменяются только в поверхностном слое, а внутренняя часть изделия остается достаточно пластичной. Для придания твердости и износостойкости поверхности стали ее подвергают цементации или азотированию. Цементация — насыщение поверхностного слоя стали углеродом с образованием цементита. Оно проводится путем нагревания готовых изделий в атмосфере метана (природного газа), а также в твердых смесях, в состав которых входят древесный уголь, сода и поташ. Азотированием называют насыщение стали азотом, который с железом и легирующими элементами дает твердые нитриды. Для этого стальные изделия нагревают в атмосфере аммиака при 500—600 °С. Тогда азот, образующийся в результате диссоциации аммиака, диффундирует в сталь и образует слой нитридов (0,5—2 мм), обладающий повышенной твердостью. Для придания стальным изделиям жаростойкости их поверхность насыщают алюминием. Этот процесс называют алитированием или калоризацией. Его проводят путем нагревания изделий в порошке ферроалюминия. [c.152]
Физические и химические свойства метана, из которого, в основном, и состоит природный газ, обстоятельно изучены. [c.5]
Физические и химические свойства соседних гомологов настолько близки, что эти смеси часто очень трудно разделять. Выделение нз них индивидуальных соединений связано с такими большими затратами, что становится более целесообразным получать их другими методами, включая промышленный или лабораторный синтез. Фракционной перегонкой природных газов или легких фракций нефти можно получить только наиболее простые алканы (с молекулами, содержащими от С1 до С11). [c.68]
Справочник состоит из б разделов, составленных в общепринятой табличной форме. В первом разделе Неорганические вещества. Физические свойства и реакционная способность приведены формулы и названия, относительные молекулярные массы, некоторые физические свойства (температура фазовых переходов, окраска, агрегатное состояние), а также сведения о реакционной способности (химических свойствах) веществ по отношению к распространенным растворителям и реактивам (воде, этанолу, хлороводородной, серной и-азотной кислотам, гидроксиду натрия и гидрату аммиака). В последующих разделах охарактеризованы атомные, молекулярные и термодинамические свойства атомов, молекул, радикалов и ионов неорганических веществ, существующих в индивидуальном состоянии и в водном растворе. Представлены относительные атомные массы элементов, свойства природных и радиоактивных изотопов, электронные формулы атомов, энергии ионизации и сродство к электрону для атомов и молекул, энергии и длины химических связей, строение (геометрическая форма) молекул веществ, в том числе и комплексных соединений Приведены термодинамические константы веществ во всех агрегатных состояниях (газ, жидкость, твердое состояние, состояние водного раствора), окислительно-восстановительные потенциалы, константы кислотности и основности, константы устойчивости комплексов в водном растворе и растворимость веществ в воде. В последнем разделе Номенклатура неорганических веществ сформулированы правила составления химических формул и на их основе химических названий веществ. [c.5]
Геология — это наука о составе, строении и истории Земли. В настоящее время установлено существование внутри земного шара нескольких оболочек литосферы, мантии и ядра. Литосфера — это внешняя твердая оболочка, распространяющаяся на глубину 50-70 км от поверхности Земли. Ниже литосферы расположена следующая оболочка — мантия, глубина которой до 2900 км. Наконец, в центральной части земного шара на глубине от 2900 до 6380 км расположено ядро. Все полезные ископаемые, в том числе нефть и газ, сосредоточены в верхней зоне земного шара — литосфере. Литосферу называют также земной корой. Земная кора сложена горными породами, различными по составу и свойствам. Горные породы, в свою очередь, состоят из минералов. Минералы — это природные химические соединения, представленные приблизительно однородными по составу и физическим свойствам телами и образующиеся при различных физико-химических процессах, протекающих в земной коре. Горные породы — это природные агрегатные минеральные соединения, возникшие в результате геологических процессов и слагающие земную кору в виде самостоятельных геологических тел. В зависимости от происхождения все горные породы принято разделять на магматические, осадочные и метаморфические. Магматические или изверженные горные породы — это горные породы обычно силикатного состава (кремнеземные), образующиеся в результате застывания и кристаллизации магмы. Осадочные горные породы — это породы, сформировавшиеся при осаждении главным образом в водной среде минеральных и органических веществ и последующем их уплотнении и изменении. Осадочные горные породы наиболее распространенные, так как они покрывают около 75 % всей земной поверхности и составляют около 10 % массы земной коры. В зависимости от характера осаждения осадочные горные породы разделяются на обломочные, химические и биогенные. Метаморфические горные породы включают породы, образовавшиеся в результате изменения осадочных или магматических (изверженных) пород при метаморфизме с полным или значительным изменением минералогического состава, структуры и текстуры. Метаморфизм в переводе с греческого означает «подвергнутый превращению» и связан с изменением структуры, минералогического, а иногда и химического состава гор- [c.29]
Расчет процесса горения топлива. Топливо в печах сжигается с целью получения теплоносителя с заданной температурой и химической активностью, которая необходима для осуществления термотехнологических процессов. В качестве топлива в печах в основном применяется природный и печной газы, мазут. Химический состав и физические свойства и теплотехнические характеристики топлив приводятся в справочниках. [c.146]
Физические и химические свойства серы и ее соединений достаточно подробно приведены в специальной литературе. В настоящем разделе рассмотрены свойства соединений, которые имеют значение в процессах очистки природного газа и не( е-продуктов от серы. [c.16]
В литературе описаны и в аналитической практике применяют большое число методов анализа соединений серы в природных газах и нефтях, основанных на различных физических и химических свойствах элементов смеси и их соединений. [c.28]
Диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ) нашли широкое применение в промысловых установках абсорбционной осушки природного газа, а в будущем планируется перевод с ДЭГ на ТЭГ и некоторых станций ПХГ. Как класс химических соединений гликоли обладают высокой гигроскопичностью, хорошей термической стабильностью и небольшой упругостью паров. Индивидуальные физические свойства гликолей значительно различаются [32]. Вследствие этого наблюдается различие в работе этих жидкостей при осушке природного газа, а потому различаются и их потери, возникающие в процессе осушки газа от влаги. [c.273]
Аналитическая методика определения редких газов весьма сложна, что обусловлено их химической инертностью и ничтожным содержанием в исследуемых газах (воздухе, природных газах и т. д.). Отмеченное обстоятельство приводит к тому, что основные методы анализа редких газов базируются на их характерных физических свойствах теплопроводности, коэфициенте преломления, потенциалах зажигания, характерных спектрах, плотности, адсорбционной способности и пр. Подробное изложение сложной методики анализа редких газов должно составлять предмет специального руководства. В настоящей главе дается описание основных методов анализа редких газов. [c.134]
Б. Г. Еремина. Газовый анализ. Госхимиздат, 1955, (380 стр.). В книге описаны физико-химические свойства газов, методы получения газов в лаборатории и способы обращения с ними. Подробно описываются современные физические и физико-химические методы газового анализа, а также специальные методы анализа природных и промышленных газов. Отдельная глава посвящена новейшим автоматическим газоанализаторам и сигнализаторам. [c.490]
Как было отмечено, практически все компоненты природных и нефтяных газов различаются физико-химическими свойствами. Эти различия служат основой для разработки процессов переработки газожидкостных смесей. Причем имеется прямая зависимость между соотношением физических констант и движущей силой процесса разделения компонентов. [c.21]
Соединения металлов и неметаллов с серой — сульфиды — являются одним из важнейших в практическом и в теоретическом отношении классов неорганических соединений. Сера обладает высокой химической активностью и образует соединения практически со всеми элементами Периодической системы Д. И. Менделеева, за исключением инертных газов. Наибольшее число сульфидных фаз образуют переходные металлы. Многие природные соединения цветных и редких металлов являются сульфидами. Сульфиды широко используют в металлургии цветных и редких металлов, технике полупроводников и люминофоров, аналитической химии, химической технологии, машиностроении. Особенно интересны сульфиды переходных металлов П1—VI групп Периодической системы, физико-химические свойства и методы получения которых еще сравнительно мало изучены. Некоторые физические и физико-технические свойства сульфидов переходных металлов уникальны (термоэлектрические, магнитные, смазочные, каталитическая активность). [c.5]
В ней освещаются физико-химические свойства газов, методы их получения в лаборатории и способы обращения с ними подробно описываются современные физические методы газового анализа. Особое внимание в книге уделяется прикладным, практическим вопросам газового анализа. Поэтому широко разбираются специальные методы анализа природных и промышленных газов, экспрессные методы анализа воздуха, имеющие большое значение для быстрого решения вопроса о степени загрязнения воздушной среды производственных помещений, а также автоматические, непрерывно действующие приборы — газоанализаторы и сигнализаторы, приобретающие все большее значение для текущего контроля производства, для регулирования производственных процессов по составу газовой смеси и для решения вопроса о степени опасности и вредности создавшихся в производственных помещениях условий. [c.6]
Ввиду сложности и чрезвычайной важности последного критерия приемлемости газа-замеиителя вопросу взаимозаменяемости газов, т. е. определению параметров горения, обеспечивающих замену одного газа другим без изменения эксплуатационных характеристик топочного оборудования, посвящена отдельная глава (гл. 3). В настоящей главе рассматриваются и сравниваются другие физические и химические свойства природных газов и их компонентов, которые играют немаловажную роль при решении вопроса о возможности их замены. [c.22]
Физические свойства. Кислород — газ без цвета, вкуса и запаха, немного тяжелее воздуха. В воде мало растворим (в 1 л воды при 20°С растворяется 31 мл кислорода). При температуре —183°С и давлении 101,325 кПа кислород переходит в жидкое состояние. Жидкий кислород имеет голубоватый цвет, втягивается в магнитное поле. Природный кислород содержит три изотопа 0 (99,76%), 0 (0,04%) и 0 (0,20%) Химические свойства. Для завершения внешнего электронного уровня атому кислорода не хватает двух электронов. Энергично при нимая их, кислород проявляет степень окисления —2. Однако в соеди нениях с фтором (ОРа и О2Р2) общие электронные пары смещены к фто ру, как к более электроотрицательному элементу. В этом случае сте пеки окисления кислорода соответственно равны +2 и +1, а фтора —I Молекула кислорода состоит из двух атомов Оа. Химическая связь в ней — ковалентная неполярная. [c.175]
Природным аналогом вещества поликомпонентного состава, включающим разные группы легких органических соединений, тяжелые углеводороды, сопутствующие природные газы, сероводород и сернистые соединения, высокоминерализованные воды с преобладанием хлоридов кальция и натрия, тяжелые металлы, включая ртуть, никель, ванадий, кобальт, свинец, медь, молибден, мышьяк, уран и др., является нефть [Пиков-ский, 1988]. Особенности действия отдельных фракций нефти и общие закономерности трансформации почв изучены достаточно полно [Солнцева,. 1988]. Наиболее токсичны по санитарно-гигиеническим показателям вещества, входящие в состав легкой фракции. В то же время, вследствие летучести и высокой растворимости их действие обычно не бывает долговременным. На аоверхности почвы эта фракция в первую очередь подвергается физико-химическим процессам разложения, входящие в ее состав углеводороды наиболее быстро перерабатываются микроорганизмами, но долго сохраняются в нижних частях почвенного профиля в анаэробной обстановке [Пиковский, 1988]. Токсичность более высокомолекулярных органических соединений выражена значительно слабее, но интенсивность их разрушения значительно ниже. Вредное экологическое влияние смолисто-асфальтеновых компонентов на почвенные экосистемы заключается не в химической токсичности, а в значительном изменении водно-физических свойств почв. Если нефть просачивается сверху, ее смолисто-асфальтеновые компоненты и циклические соединения сорбируются в основном в верхнем, гумусовом горизонте, иногда прочно цементируя его. При этом уменьшается норовое пространство почв. Эти вещества малодоступны микроорганизмам, процесс их метаболизма идет очень медленно, иногда десятки дет. Подобное действие тяжелой фракции нефти наблюдается на территории Ишимбайского нефтеперерабатывающего завода. Состав органических фракций выбросов других предприятий представлен в подавляющем большинстве легколетучими соединениями. [c.65]
Для изготовления пар трения, тяжелонагруженных деталей и изделий ответственного назначения, работающих в условиях трения и износа, в химическом машиностроении широко применяются углеродистые качественные и легированные конструкционные стали обычно в закаленно-отпущенном состоянии. Данные стали имеют удовлетворительную химическую стойкость при работе в контакте с осушенным хлором, газообразным и жидким водородом при температуре от —40 до 150° С, природным газом, метанолом, жидким и газообразным аммиаком, силиконовой жидкостью с добавками фосфитов при производстве полиэтилена высокого давления, органическими растворителями, оксиэтилепом и другими малоагрессивными и нейтральными в коррозионном отношении средами [22, 48]. Химический состав сталей приведен в ГОСТ 1050—60 и ГОСТ 4543—71, а физические свойства—в табл. 15. [c.43]
На растворимость химических элементов и их соединений влияют многие факторы. Постоянными из них являются химические и физические свойства самого элемента, переменными — условия среды концентрация водородных ионов, окислительно-восстановительный потенциал среды, концентрация ионов других элементов, наличие газов (углекислоты, кислорода, сероводорода), пластовое давление, температура и др. Все эти условия характеризуют природную обстановку, предопределяющую мета-морфизацию того или иного элемента. [c.263]
Органические соединения отличаются замечательным разнообразием физических и химических свойств. С одной стороны, пластмассы и каучук, состоящие из больших молекул, способных проявлять широкое разнообразие физических С1ЮЙСТВ, таких, как твердость, упругость, прочность на разрыв и способность к формованию. С другой стороны, газ метан — одна из самых маленьких органических молекул,— который кипит при —162° Это вещество — главный компонент природного газа. Некоторые соединения, такие, как фталоцианин, выдерживают красное каление, тогда как совсем простое соединение с формулой С4Н4 взрывает, попадая в условия комнатной температуры. Высокочувствительная фотографическая пленка представляет собой крайний случай химической реакционной способности органического соединения, которую можно противопоставить высокой химической устойчивости тефлона — фтороуглеродной пластмассы столь инертной, что она выдерживает даже агрессивный газ фтор. [c.15]
Не изменяя главных своих химических свойств, уголь может претерпевать изменения в своем сложении и в физических свойствах, т.-е. может переходить в два другие изомерные или аллотропические видоизмеиеиня графит и алмаз. Тожество состава их с углем видно из того, что одинаковое количество этих трех веществ при сжигании в кислороде (при действии сильного жара) дает одинаковое количество углекислого газа, а именно, 12 ч. угля, алмаза и графита в чистом виде дают при сожигании 44 вес. ч. углекислого газа. В физическом же отношении различие весьма резко самые плотные сорта угля имеют плотности не более 1,8, графит же около 2,3, алмаз 3,5, от чего зависит множество других свойств, напр., горючесть чем легче уголь, тем удобнее он сожигается графит горит даже в кислороде весьма затруднительно алмаз же горит только в кислороде и только при весьма сильном накаливании. При горении угля, алмаза и графита отделяется неодинаковое количество тепла. При сожигании в углекислый газ 1 вес. ч- древесного угля отделяется 8080 единиц тепла плотный уголь, отлагающийся в газовых ретортах, выделяет 8050 единиц тепла, природный графит 7800 единиц тепла, алмаз 7770 единиц тепла. Чем больше плотность, тем меньше выделяется тепла. Уплотняясь, уголь теряет часть своей внутренней энергии (теплоту), значит, плотнейшее состояние относится к менее плотному, как твердое к жидкому, или как соединенное к свободному. Поэтому следует думать, что частица графита сложнее, чем угля, а у алмаза еще сложнее. То же показывает и теплеем- [c.253]
Лучшие результаты в отношении четкости разделения получаются на ректификационной колонке Подбельняка. Однако и в этом случае при сложных газовых смесях пе может быть достигнуто полное разделение во фракциях Сд—С всех могуш,их встретиться углеводородных компонентов. Поэтому для проведения анализа сложных газовых смесей, содержаш,их разнообразные предельные и непредельные углеводороды, а также неуглеводородные газы, было предложено комбинировать низкотемпературную разгонку с химическим поглотительным анализом и некоторыми определениями физических свойств газов [3]. Подобный комбинированный анализ позволяет наиболее полно определить компоненты природных и промышленных газов. [c.97]
Теплоизлучение газового факела и продуктов горения. При отоплении различных печных установок твердым и жидким топливом высокая радиационная способность факела обусловливалась физическими и химическими свойствами этих видов топлива и мало зависела от режима их сжигания. С переводом же промышленных печных и. котельных агрегатов на отопление природным газом при некоторых типах горелок и способах его сжигания теплоотдача излучением значительно понизилась. Однако до сего времени у специалистов по газовому отоплению нет еще единого мнения об оптимальных режимах сжигания природного газа в различных печных установках, экспериментальные и производственные данные часто противоречивы, и вопрос о рациональности получения так называемого светящегося или несветящегося факела остается еще дискуссионным. Так, например, Н. А. Захариков [16] наблюдал на модели мартеновской печи, что когда природный газ сгорал несветящимся факелом, количество тепла, переданного тепловоспринимающей поверхности, в определенных условиях было на 5—6% выше, чем при светящемся факеле. Проф. И. А. Семененко в Московском энергетическом институте им. Ленина в лабораторных условиях установил, что высокая радиационная эффективность факела горения природного газа в мартеновских печах может быть получена и при несветящемся факеле за счет аэродинамических факторов — интенсивного смешения и скоростного сжигания природного газа. На целесообразность сжигания природного газа несветящимся факелом во вращающихся печах указывает [c.89]
Известно много видов горючих газов, отличающихся друг от друга химическим составом, физическими свойствами и теплотой сгорания, которые используют.в качестве топлива для разнообразных термических процессов. Для газоснабжения городов применяют только те искусственные и природные газы, объемная теплота сгорания которых составляет не менее 1,5—-1,7 МДж/м . Объясняется это тем, что газы, характеризующиеся содержанием небольшого количества тепла в единице объема и имеющие, как правило, большую плотность, требуют высоких металловложений и капитальных затрат на сооружение газовых сетей. При этом удорожается и усложняется аппаратура по учету и использованию горючих газов и несколько снижается ее к. п. д. Недостаток горючих газов с низкой теплотой сгорания — содержание в них значительного количества окиси углерода. [c.7]
Поскольку актиний трудно выделить из природных источников, исследователи давно пришли к выводу, что химические свойства актиния очень близки к химическим свойствам лантана и редкоземельных элементов. Актиний, как и редкоземельные элементы, образует не растворимые в воде фторид, гидроокись, оксалат, карбонат и фосфат. Физические свойства галогенидов актиния, насколько они изучены, очень похожи на свойства соответствующих галогенидов редких земель. Все те чистые соединения актиния, которые были приготовлены и охарактеризованы, изострук-турны с соответствующими соединениями лантана. Кристаллохимические исследования показали, что размеры иона Ас наибольшие из всех известных трехзарядных ионов радиус его равен 1,10 А. Ионный радиус лантана равен 1,06 А, небольшое различие ионных радиусов (0,04 А), наряду с тем фактом, что оба иона имеют аналогичную электронную структуру инертного газа, в равной мере обусловливает сходство химических свойств. Заключение о подобии актиния и редких земель подтверждается его поведением при соосаждении с носителями. Из табл. 2.2 очевидно, что химические свойства Ас , о которых можно судить на основании наблюдаемого поведения при соосаждении с носителями, действительно [c.19]
Химическое отделение Направление научных исследований электрические и механические свойства молекулярных кристаллов термодинамика смесей жидкостей диффузия газов фториды металлов и неметаллов неводные растворители спектроскопия неорганических комплексов вольфрама термическая диссоциация неорганических комплексных соединений кондуктометрическое титрование кинетика неорганических реакций реакции лигандов магнетохимия химия металлорганических соединений ароматические соединения окисление фенола биосинтез нтеридинов химия антибиотиков и других лекарственных веществ ЯМР- и ИК-спектроскопия стероидов и алкалоидов химия терпенов и гетероциклических соединений реакции металлсодержащих хелатов р-дикетонов алкалоиды и природные хиноны физические свойства и строение полимеров гетерогенный катализ. [c.271]
Основная I адача технического анализа в нефтегазоперерабатывающей промыщленности — наиболее полно и четко охарактеризовать необходимые химические, физические и эксплуатационные свойства конечных продуктов производства с учетом специфических особенностей их назначения и применения. Не менее важной задачей технического анализа является производственно-технологическая оценка исходного сырья сырой нефти, дистиллятных и остаточных нефтяных продуктов, природного, попутного и промыщ-ленных углеводородных газов. В задачи технического анализа в нефтегазоперерабатывающей промышленности входит также определение состава и свойств катализаторов, технической воды и ряда вспомогательных материалов и реагентов. [c.4]
В настоящее время в Российской Федерации получило развитие новое направление топливно-энер-гетического комплекса — производство сжиженного природного газа (СПГ) По физическим свойствам СПГ представляет собой жидкость без запаха и цвета плотностью около 400 кг/мз, с температурой кипения при атмосферном давлении около -161 С В химическом составе СПГ преобладает метан (не менее 98 %) Низкие температуры существования жидкой фазы условливают жесткие трепания к материалам ис-уемого оборудования и роводов [c.44]
Первая часть учебника включает разделы, посвященные физико-химическим свойствам и классификации нефтей и нефтепродуктов, физическим методам переработки природных углеводородных газов, процессам подготовки нефти к переработке и технологии первичной переработки нефти. Вторая часть посвящена технологии вторичных методов переработки нефти и газа (термических, каталитических и гидрогенизационных), предназначенных для производства различных видов топлив и сырья для нефтехимической промышленности. В третьей части иззп1аются процессы очистки нефтепродуктов с целью, придания им товарных качеств и технология производства специальных продуктов. [c.9]
Наряду-с твердым углйстым ос-тат-ком — по- ыраже- -нию Ф. Бергиуса, конечным углем ) выделялись вода и углекислый газ. И что было наиболее удивительным — твердый остаток по содержанию углерода, водорода и кислорода напоминал нормальные пламенные угли. Но некоторое сходство это еще не тождество. Для того чтобы убедиться в том, что полученное вещество было действительно родственником природного каменного угля, необходимо было изучить его физические и химические свойства. [c.13]
Свойства газа — Химия LibreTexts
Цели обучения
Убедитесь, что вы полностью понимаете следующие важные идеи:
- Укажите в три основных свойства газов , которые отличают их от конденсированных фаз вещества.
- Определите давление и объясните, почему газ оказывает давление на стенки контейнера.
- Объясните, как работает простой барометр и почему его изобретение произвело революцию в нашем понимании газов.
- Объясните, почему барометр, использующий воду в качестве барометрической жидкости, обычно менее практичен, чем барометр, в котором используется ртуть.
- Как определяются температурные шкалы Цельсия и Фаренгейта ? Как соотносятся величины «градуса» на каждой шкале?
- Почему при сообщении объема газа необходимо указывать температуру и давление?
Изобретение чувствительных весов в начале семнадцатого века раз и навсегда показало, что газы имеют вес и, следовательно, являются материей.Изобретение Герике воздушного насоса (которое привело непосредственно к открытию им вакуума ) положило начало «пневматической эре» химии задолго до того, как существование атомов и молекул было признано. Действительно, поведение газов вскоре должно было доказать неоценимую роль. инструмент в развитии атомной теории материи.
Введение
Изучение газов позволяет нам понять поведение материи в простейшем виде: отдельные частицы, действующие независимо друг от друга, почти полностью не усложняются взаимодействиями и интерференциями друг с другом.Эти знания о газах послужат путем к нашему пониманию гораздо более сложных конденсированных фаз (жидкости и твердые тела), в которых теория газов больше не даст нам правильных ответов, но все же даст нам полезный модель , которая, по крайней мере, поможет нам рационализировать поведение этих более сложных состояний материи.
Во-первых, мы знаем, что газ не имеет определенного объема или формы ; газ заполнит любой доступный ему объем.Сравните это с поведением жидкости, которая всегда имеет отчетливую верхнюю поверхность, когда ее объем меньше объема занимаемого ею пространства. Другой выдающейся характеристикой газов является их низкая плотность по сравнению с плотностью жидкостей и твердых тел. Один моль жидкой воды при 298 К и давлении 1 атм занимает объем 18,8 см 3 , тогда как такое же количество водяного пара при той же температуре и давлении имеет объем 30200 см 3 , что более чем в 1000 раз больше .
Самым замечательным свойством газов, однако, является то, что в очень хорошем приближении все они ведут себя одинаково в ответ на изменения температуры и давления, расширяясь или сжимаясь на предсказуемые величины. Это сильно отличается от поведения жидкостей или твердых тел, в которых свойства каждого конкретного вещества должны определяться индивидуально. Позже мы увидим, что каждая из этих трех макроскопических характеристик газов следует непосредственно из микроскопической точки зрения , то есть из атомарной природы вещества.
Давление газа
Молекулы газа, находясь в непрерывном движении, часто ударяются о внутренние стенки своего сосуда. При этом они сразу же отскакивают без потери кинетической энергии, но изменение направления (ускорение , ) сообщает стенкам контейнера усилие и . Эта сила, разделенная на общую площадь поверхности, на которую она действует, составляет давление газа.
Давление газа измеряется путем измерения давления, которое должно быть приложено извне, чтобы предотвратить расширение или сжатие газа.Чтобы представить себе это, представьте себе газ, заключенный в цилиндр, один конец которого окружен свободно движущимся поршнем. Для удержания газа в баллоне на поршень должен быть приложен определенный груз (точнее, сила , f ), чтобы точно уравновесить силу, оказываемую газом на нижнюю часть поршня, и стремится подтолкнуть его. Давление газа — это просто частное f / A , где A — площадь поперечного сечения поршня.
Единицы давления
Единицей давления в системе СИ является паскаль (Па), определяемая как сила в один ньютон на квадратный метр (1 Нм –2 = 1 кг · м –1 с –2 .) На поверхности Земли сила тяжести, действующая на массу в 1 кг, составляет 9,81 Н. Таким образом, если вес составляет 1 кг, а площадь поверхности поршня составляет 1 M 2 , давление газа будет 9,81 Па. Гиря весом 1 грамм, действующая на поршень с поперечным сечением 1 см 2 , создаст давление 98,1 пА. (Если вам интересно, почему давление выше во втором примере, рассмотрите количество см 2 , содержащееся в 1 м 2 .)
В химии часто принято выражать давление в единицах атмосфер или торр : 1 атм = 101325 Па = 760 торр.Более старая единица измерения миллиметр ртутного столба (мм рт. Ст.) Почти такая же, как торр, и определяется как один мм разницы уровней в ртутном барометре при 0 ° C. {- 2}} {9.{-2} \]
Пример \ (\ PageIndex {1} \)
Если на ваше тело постоянно давят несколько килограммов воздуха, почему вы этого не чувствуете?
Решение
Поскольку все остальные части вашего тела (включая легкие и внутреннюю часть) также испытывают такое же давление, на вас не действует никакая чистая сила (кроме силы тяжести).
Это был решающий первый шаг, который в конечном итоге привел к концепции газов и их важной роли в раннем развитии химии.В начале 17 века итальянка Евангелиста Торричелли изобрела прибор — барометр — для измерения давления атмосферы. Несколько лет спустя немецкий ученый и бывший мэр Магдебурга Отто фон Герике изобрел метод откачки воздуха из контейнера, создав, таким образом, противоположность воздуху: вакуум .
Как и многие другие достижения науки, идея вакуума — области небытия — была принята не сразу.Изобретение Торричелли опровергло тогдашнее распространенное мнение о невесомости воздуха (и, соответственно, всех газов). Тот факт, что мы живем на дне воздушного моря, был наиболее наглядно продемонстрирован в 1654 году, когда две упряжки по восемь лошадей не смогли развести два 14-дюймовых медных полушария («Магдебургские полушария»), которые были соединены вместе и затем откачивают с помощью недавно изобретенного вакуумного насоса Герике.
Классический барометр, который до сих пор используется для наиболее точной работы, измеряет высоту столба жидкости, который может поддерживаться атмосферой.Как указано ниже, это давление действует непосредственно на жидкость в резервуаре и передается гидростатически жидкости в колонне.
Металлическая ртуть, будучи жидкостью исключительно высокой плотности и низкого давления пара, является идеальной барометрической жидкостью. Его широкое использование привело к появлению «миллиметра ртутного столба» (теперь обычно называемого «торр») в качестве меры давления.
Пример \ (\ PageIndex {2} \): водяной барометр
Как давление воздуха 1034 г см –3 связано с высотой 760 мм ртутного столба в барометре? Что, если бы вместо ртути использовали воду?
Решение
Плотность Hg 13.6 г см –3 , поэтому в колонне с поперечным сечением 1 см 2 высота, необходимая для противодействия атмосферному давлению, будет (1034 г × 1 см 2 ) / (13,6 г см — 3 ) = 76 см.
Плотность воды составляет всего 1 / 13,6 от плотности ртути, поэтому стандартное атмосферное давление поддерживает столб воды, высота которого составляет 13,6 x 76 см = 1034 см, или 10,3 м. Надо бы читать водяной барометр из окна четвертого этажа!
Водные барометры когда-то использовались для измерения высоты земли и высот зданий до того, как были приняты более современные методы.
Модификация барометра, манометр с U-образной трубкой , представляет собой простое устройство для измерения давления любого газа в баллоне. U-образная трубка частично заполнена ртутью, один конец соединен с контейнером, а другой конец может быть открыт в атмосферу. Давление внутри контейнера определяется по разнице высот ртути на двух сторонах U-образной трубки. На рисунке ниже показано, как работают два типа манометров.
Рисунок \ (\ PageIndex {3} \): На манометре с открытой трубкой справа атмосфера толкает столб ртути вниз на открытой стороне, и снова давление в торр определяется по разнице уровней.При использовании этого метода атмосферное давление необходимо определять с помощью барометра.Манометры, обычно используемые в лаборатории, бывают двух видов: закрытые и открытые. В блоке с закрытой трубкой, показанном слева, из более длинного конца J-образной трубки откачивается воздух, заполняя его ртутью и затем переворачивая. Если контейнер для образца также откачивается, уровень ртути будет одинаковым в обеих конечностях. Когда газ попадает в контейнер, его давление толкает ртуть вниз с одной стороны и вверх с другой; разница в уровнях — это давление в торр.Для практического применения в машиностроении и промышленности, особенно там, где необходимо контролировать более высокое давление, доступны многие типы механических и электрических манометров .
Температура газа
Если два тела имеют разную температуру, тепло будет течь от более теплого к более холодному, пока их температуры не станут одинаковыми. Это принцип, на котором основана термометрия ; температура объекта измеряется косвенно, помещая в контакт с ним откалиброванное устройство, известное как термометр .Когда достигается тепловое равновесие, температура термометра совпадает с температурой объекта.
Термометр использует некоторую зависящую от температуры величину, такую как плотность жидкости, чтобы позволить определить температуру косвенно через некоторую легко измеряемую величину, такую как длина ртутного столба. Полученная шкала температуры совершенно произвольна; он определяется расположением его нулевой точки и размером единицы градусов .В какой-то момент в 18 -м годах использовалось 35 различных температурных шкал! Температурная шкала Цельсия (формально называемая градусом Цельсия) определяет нулевую точку при температуре замерзания воды; Степень Цельсия определяется как 1/100 разницы между температурами замерзания и кипения воды при давлении 1 атм.
Более старая шкала по Фаренгейту помещала нулевую точку на самую низкую температуру, которую можно было получить в то время (путем смешивания соли и льда.) Точка 100 ° была установлена с температурой тела (позже выяснилось, что она составила 98,6 ° F). По этой шкале вода замерзает при 32 ° F и закипает при 212 ° F. Шкала Фаренгейта более тонкая, чем шкала Цельсия; есть 180 градусов по Фаренгейту в том же температурном интервале, который содержит 100 градусов по Цельсию, поэтому 1 F ° = 5/9 C °. Поскольку нулевые точки также различаются на 32F °, преобразование между температурами, выраженными на двух шкалах, требует сложения или вычитания этого смещения, а также умножения на коэффициент размера градуса.
Вы должны уметь вывести формулы для этого преобразования.
Абсолютная температура
В 1787 году французский математик и физик Жак Шарль обнаружил, что на каждый градус Цельсия, на который понижается температура газа, объем газа уменьшается на 1/273 его объема при 0 ° C. Очевидным следствием этого является то, что если бы температуру можно было снизить до –273 ° C, объем газа уменьшился бы до нуля. Конечно, все реальные газы конденсируются в жидкости до того, как это произойдет, но при достаточно низких давлениях их объемы являются линейными функциями температуры ( Закон Чарльза ), и экстраполяция графика объема как функции температуры предсказывает нулевой объем при -273 ° С.Эта температура, известная как абсолютный ноль , соответствует полному отсутствию тепловой энергии.
Температурная шкала с нулевой точкой –273,15 ° C была предложена лордом Кельвином и обычно известна как шкала Кельвина и . Поскольку размеры градусов Кельвина и Цельсия одинаковы, преобразование между двумя шкалами представляет собой простой вопрос добавления или вычитания 273,15; таким образом, комнатная температура, 20 °, составляет около 293 К.
Поскольку шкала Кельвина основана на абсолютном значении, а не на произвольном нуле температуры, она играет особое значение в научных расчетах; большинство фундаментальных физических соотношений, связанных с температурой, математически выражаются через абсолютную температуру.В инженерных работах иногда используется абсолютная шкала, основанная на градусах Фаренгейта; она известна как шкала Ренкина .
Объем, занимаемый газом
Объем газа — это просто пространство, в котором молекулы газа могут свободно перемещаться. Если у нас есть смесь газов, например, воздух, разные газы будут сосуществовать в одном и том же объеме. В этом отношении газы сильно отличаются от жидкостей и твердых тел, двух конденсированных состояний вещества.Объем газа можно измерить, удерживая его над ртутью в калиброванной трубке, известной как газовая бюретка . Единицей объема в системе СИ является кубический метр, но в химии мы чаще используем литров и миллилитр (мл). кубический сантиметр (куб.см) также часто используется; это очень близко к 1 миллилитру (мл).
Однако важно помнить, что объем газа зависит как от температуры, так и от давления, поэтому сообщать только об объеме не очень полезно.Обычной практикой является измерение объема газа при температуре окружающей среды и атмосферном давлении, а затем корректировка наблюдаемого объема до того, что было бы при стандартном атмосферном давлении и некоторой фиксированной температуре, обычно 0 ° C или 25 ° C.
Авторы и ссылки
1.3 Физические и химические свойства — химия
Цели обучения
К концу этого раздела вы сможете:
- Определять свойства и изменения вещества как физические или химические
- Определять свойства материи как экстенсивные или интенсивные
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами.Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи). Мы наблюдаем физические изменения, когда воск тает, когда сахар растворяется в кофе и когда пар конденсируется в жидкую воду (рис. 1). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными бирками для защиты от кражи) и измельчение твердых частиц в порошки (которые иногда могут приводить к заметным изменениям цвета).В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Рис. 1. (a) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (б) Конденсация пара внутри кастрюли — это физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит а: модификация работы «95jb14» / Wikimedia Commons; кредит б: модификация работы «mjneuby» / Flickr)Изменение одного типа вещества в другой тип (или невозможность изменения) — это химическое вещество . недвижимость .Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется (рис. 2). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Рис. 2. (a) Одно из химических свойств железа — ржавчина; (б) одно из химических свойств хрома состоит в том, что это не так.(кредит а: модификация работы Тони Хисгетта; кредит б: модификация работы «Атома» / Wikimedia Commons)Чтобы определить химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества.Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения) и приготовление, переваривание или гниение пищи (рис. 3).
Рис. 3. (a) Медь и азотная кислота претерпевают химические изменения с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза в спичке и кислород воздуха подвергаются химическому изменению с образованием диоксида углерода и водяного пара.(c) Приготовление красного мяса вызывает ряд химических изменений, включая окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (г) Банан становится коричневым — это химическое изменение, связанное с образованием новых, более темных (и менее вкусных) веществ. (Фото b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)Свойства материи можно разделить на две категории. Если свойство зависит от количества присутствующего вещества, это обширное свойство .Масса и объем вещества являются примерами обширных свойств; например, галлон молока имеет большую массу и объем, чем чашка молока. Стоимость обширной собственности прямо пропорциональна количеству рассматриваемого вещества. Если свойство образца вещества не зависит от количества присутствующего вещества, это интенсивное свойство . Температура — это пример интенсивного свойства. Если галлон и чашка молока имеют температуру 20 ° C (комнатная температура), при их объединении температура остается на уровне 20 ° C.В качестве другого примера рассмотрим различные, но взаимосвязанные свойства тепла и температуры. Брызги горячего кулинарного масла на руку вызывают кратковременный небольшой дискомфорт, а горшок с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Опасный алмаз
Вы могли видеть символ, показанный на Рисунке 4, на контейнерах с химикатами в лаборатории или на рабочем месте.Этот алмаз с химической опасностью, который иногда называют «огненным алмазом» или «опасным алмазом», дает ценную информацию, которая кратко описывает различные опасности, о которых следует помнить при работе с определенным веществом.
Рис. 4. Алмазный алмаз Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.Национальное агентство противопожарной защиты (NFPA) 704 Система идентификации опасностей была разработана NFPA для предоставления информации о безопасности определенных веществ.Система детализирует воспламеняемость, реактивность, здоровье и другие опасности. Верхний (красный) ромб внутри общего символа ромба указывает уровень пожарной опасности (диапазон температур для точки вспышки). Синий (левый) ромб указывает на степень опасности для здоровья. Желтый (правый) ромб указывает на опасность реакционной способности, например, насколько легко вещество подвергнется детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особые опасности, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха / кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологическая опасность, радиоактивность и т. д.Каждая опасность оценивается по шкале от 0 до 4, где 0 означает отсутствие опасности, а 4 — чрезвычайно опасную.
Хотя многие элементы сильно различаются по своим химическим и физическим свойствам, некоторые элементы обладают схожими свойствами. Мы можем идентифицировать наборы элементов, которые демонстрируют общее поведение. Например, многие элементы хорошо проводят тепло и электричество, а другие плохо проводят. Эти свойства можно использовать для сортировки элементов по трем классам: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы, обладающие свойствами как металлов, так и неметаллов).
Периодическая таблица — это таблица элементов, в которой элементы с похожими свойствами расположены близко друг к другу (рис. 4). Вы узнаете больше о таблице Менделеева, продолжая изучать химию.
Рис. 4. Периодическая таблица показывает, как элементы могут быть сгруппированы по определенным схожим свойствам. Обратите внимание, что цвет фона указывает, является ли элемент металлом, металлоидом или неметаллом, тогда как цвет символа элемента указывает, является ли элемент твердым, жидким или газообразным.Все вещества обладают определенными физическими и химическими свойствами и могут претерпевать физические или химические изменения. Физические свойства, такие как твердость и температура кипения, и физические изменения, такие как плавление или замерзание, не влекут за собой изменение состава вещества. Химические свойства, такие как воспламеняемость и кислотность, а также химические изменения, такие как ржавление, приводят к образованию вещества, которое отличается от того, что было раньше.
Измеримые свойства делятся на две категории.Обширные свойства зависят от количества присутствующего вещества, например, от массы золота. Интенсивные свойства не зависят от количества присутствующего вещества, например, плотности золота. Тепло — это пример экстенсивного свойства, а температура — пример интенсивного свойства.
Химия: упражнения в конце главы
- Классифицируйте шесть подчеркнутых свойств в следующем абзаце как химические или физические:
Фтор — это бледно-желтый газ , который реагирует с большинством веществ .Свободный элемент плавится при −220 ° C и кипит при −188 ° C . Мелкодисперсные металлы горят во фторе ярким пламенем. Девятнадцать граммов фтора вступят в реакцию с 1,0 граммами водорода .
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) конденсация пара
(б) сжигание бензина
(в) сквашивание молока
(г) растворение сахара в воде
(д) плавка золота
- Классифицируйте каждое из следующих изменений как физические или химические:
(а) сжигание угля
б) таяние льда
(c) смешивание шоколадного сиропа с молоком
(г) взрыв петарды
(д) намагничивание отвертки
- Объем пробы газообразного кислорода изменился с 10 мл до 11 мл при изменении температуры.Это химическое или физическое изменение?
- 2,0-литровый объем газообразного водорода в сочетании с 1,0 литром газообразного кислорода для получения 2,0 литров водяного пара. Кислород претерпевает химические или физические изменения?
- Объясните разницу между экстенсивными и интенсивными свойствами.
- Укажите следующие свойства как обширные или интенсивные.
(а) том
(б) температура
(в) влажность
(г) тепло
(е) точка кипения
- Плотность (d) вещества — это интенсивное свойство, которое определяется как отношение его массы (m) к его объему (V).
[латекс] \ text {density} = \ frac {\ text {mass}} {\ text {volume}} [/ latex] [latex] \ text {d} = \ frac {\ text {m}} {\ текст {V}} [/ latex]
Учитывая, что масса и объем являются экстенсивными свойствами, объясните, почему их соотношение, плотность, является интенсивным.
CDS 14 Физические свойства газов I — Закон идеального газа и кинетическая молекулярная теория
Этот курс будет охватывать темы годичного двухсеместрового курса общей химии. Мы будем использовать бесплатный онлайн-учебник «Исследования по разработке концепций в химии», доступный в рамках проекта Rice Connexions.Фундаментальные концепции курса будут представлены с помощью подхода к разработке концепций, разработанного в Университете Райса. При таком подходе мы будем развивать концепции, которые вам необходимо знать из экспериментальных наблюдений и научных рассуждений, а не просто рассказываем вам концепции, а затем просим вас просто запомнить или применить их. Так зачем использовать этот подход? Одна из причин заключается в том, что большинство из нас обучаются индуктивно, что означает, что нам нравится делать конкретные наблюдения, а затем обобщать их.Многие из наиболее важных концепций в химии противоречат интуиции. Когда мы видим, откуда берутся эти концепции, мы с большей готовностью принимаем их, объясняем и применяем. Вторая причина заключается в том, что научные рассуждения в целом и рассуждения по химии в частности являются индуктивными процессами. Этот подход к разработке концепции иллюстрирует эти процессы рассуждения. Третья причина в том, что это просто интереснее! Структура и реакции материи — это увлекательные головоломки, которые нужно решить с помощью наблюдений и рассуждений.Интеллектуально гораздо интереснее, когда мы можем разгадывать эти головоломки вместе, а не просто разгадывать загадки, разгаданные с самого начала. Рекомендуемый фон: Занятие может пройти человек, не имеющий опыта в химии. Однако желательно некоторое предварительное знакомство с основами химии, поскольку мы рассмотрим некоторые элементы лишь вкратце. Например, было бы полезно пройти предыдущий урок химии в средней школе. Рекомендуемая литература: Чтения будут назначены из онлайнового учебника «Исследования по разработке концепций в химии», доступного в рамках проекта Rice Connexions.Кроме того, мы предложим чтение из любого стандартного учебника по общей химии. Особенно хорошим бесплатным онлайн-ресурсом является Dickerson, Gray and Haight, «Chemical Principles, 3rd Edition». Ссылки на эти два текста будут доступны в модуле «Введение».
Свойства газов | Безграничная химия
Вещества, существующие в виде газов
Вещества, находящиеся в газовой фазе, обладают незначительными межмолекулярными силами.
Основные выводы
Ключевые моменты
- Газ — одно из трех классических состояний вещества (другие — жидкое и твердое).
- При стандартной температуре и давлении (STP, или 1 атм и 273 K) вещество, существующее в виде газа, называется чистым газом.
- Чистый газ может состоять из отдельных атомов (например, благородный газ или атомарный газ, такой как неон), элементарных молекул, состоящих из одного типа атомов (например, кислорода), или сложных молекул, состоящих из множества атомов (например, диоксида углерода). .
- Если температура кипения вещества ниже 273 K, то вещество должно находиться в газовой форме при STP.
Ключевые термины
- абсолютный ноль : максимально низкая температура, ноль по шкале Кельвина или приблизительно -273.15 ° С, -459,67 ° F; полное отсутствие тепла; температура, при которой движение всех молекул прекращается
Газ как состояние вещества
Газ — одно из трех классических состояний вещества (другие — жидкое и твердое). Вблизи абсолютного нуля вещество существует как твердое тело. Когда к этому веществу добавляется тепло, оно плавится в жидкость при температуре плавления, превращается в газ при температуре кипения, и при достаточно сильном нагревании он переходит в состояние плазмы, в котором электроны получают такую энергию, что покидают свои родительские атомы из внутри газа.
Состояния материи : Материя переходит между тремя классическими состояниями материи (газ, твердое тело и жидкость) и четвертым состоянием материи. Обратите внимание, что энтальпия системы — это теплосодержание системы при постоянном давлении. Процесс превращения твердого вещества в жидкость известен как «плавление»; жидкость в газ — это «испарение»; а возвращение газа в твердое состояние — это «осаждение». Эти же процессы в обратном направлении — «замораживание»; «Конденсация»; и «сублимация.”
Кинетическая теория материи
Почему материя существует в трех разных состояниях? Кинетическая теория материи дает общий обзор:
- Материя состоит из постоянно движущихся частиц.
- Все частицы обладают энергией, но энергия меняется в зависимости от того, является ли вещество твердым, жидким или газообразным; твердые частицы обладают наименьшим количеством энергии, а частицы газа — наибольшим.
- Температура вещества — это мера средней кинетической энергии частиц.
- Изменение фазы может происходить при изменении энергии частиц.
- Между частицами материи есть промежутки.
- Между частицами существуют силы притяжения, которые становятся сильнее по мере приближения частиц друг к другу. Эти силы притяжения известны как межмолекулярные силы. Предполагается, что идеальный газ не испытывает никаких межмолекулярных сил из-за того факта, что частицы идеального газа движутся так быстро и находятся так далеко друг от друга, что вообще не взаимодействуют друг с другом.
- Газы наиболее оптимально ведут себя при высоких температурах и низких давлениях. Это потому, что в этих условиях межмолекулярные силы будут минимизированы.
Interactive: молекулярный взгляд на газ : исследуйте структуру газа на молекулярном уровне. Обратите внимание, что в отличие от твердых тел, газы не имеют жесткой структуры; на микроскопическом уровне газы всегда движутся и перестраиваются.
Мы обсудили основные состояния вещества, в которые вещество может преобразовываться в зависимости от условий.В стандартных условиях (1 атм, 273 К) вещество, которое существует в виде газа, называется чистым газом и (без учета любых межмолекулярных сил, специфичных для вещества или объема частиц, которые могут изменить это значение) имеет объем 22,4 л на моль. Чистый газ может состоять из отдельных атомов (например, благородный газ или атомарный газ, такой как неон), элементарных молекул, состоящих из одного типа атомов (например, кислорода), или сложных молекул, состоящих из множества атомов (например, диоксида углерода). В STP, если точка кипения данного вещества ниже 273 K, можно ожидать, что это вещество находится в газовой форме.
Интерактивное: что такое давление? : Газы не имеют определенной формы или объема. Когда они привязаны к контейнеру, мы можем измерить давление, которое они оказывают на стенки контейнера. Модель показывает внутреннюю часть (желтые атомы) и внешнюю (зеленые атомы) воздушного шара. Бирюзовый барьер представляет собой стенку воздушного шара. Добавьте атомы в воздушный шар и посмотрите, что произойдет. Из-за повышенного давления увеличивается объем!
Элементарные газы
Элементы VIII группы (гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn)) существуют в виде одноатомных газов при стандартной температуре и давлении (STP) и являются называется благородными газами.Единственными другими элементами, которые существуют в виде газов на STP, являются водород (H 2 ), азот (N 2 ) и кислород (O 2 ), а также два галогена, фтор (F 2 ) и хлор ( Cl 2 ). Эти газы, объединенные вместе с одноатомными благородными газами, называются «элементарными газами». ”
Периодическая таблица элементов : Благородные газы (группа VIII) существуют в виде газов на STP.
СИ Единицы давления
Единицей давления в системе СИ является паскаль (Па), который равен одному Ньютону на квадратный метр (Н / м 2 ).
Цели обучения
Распознавать взаимосвязь между производными и основными единицами СИ
Основные выводы
Ключевые моменты
- Международная система единиц (СИ) является основой современной метрической системы. Все единицы СИ могут быть производными от семи основных единиц СИ.
- Диапазоны конкретных единиц обозначаются положительными или отрицательными кратными степеням десяти (например, 10 2 , 10 -2 и т. Д.).
- Давление — эффект силы, приложенной к поверхности — является производной единицей, полученной путем объединения основных единиц.
- Единицей давления в системе СИ является паскаль (Па), определяемый как сила, равная одному Ньютону на квадратный метр.
- Преобразование между атм, Па и торр выглядит следующим образом: 1 атм = 101325 Па = 760 торр.
- Стандартизированная система префиксов указывает доли и кратные метрических единиц (например, милли-, мега-).
Ключевые термины
- Международная система единиц : основа метрической системы; SI, от французской Système international d’unités; метрические измерения производятся от семи основных единиц и кратны десяти
- Ньютон : в Международной системе единиц производная единица силы; сила, необходимая для ускорения массы в один килограмм на один метр в секунду в секунду; символ: N
- паскаль : в Международной системе единиц производная единица давления и напряжения, равная одному ньютону на квадратный метр; символ: Pa
- Давление : величина силы, приложенной к данной области, деленная на ее размер.
- барометр : прибор для измерения атмосферного давления
Единицы СИ
Международная система единиц (сокращенно SI от французского Système International d’Unités) является основой метрической системы. СИ была создана в 1960 году и основана на системе метр-килограмм-секунда, а не на системе сантиметр-грамм-секунда. Единицы делятся на два класса: базовые единицы и производные единицы. Существует семь основных единиц, каждая из которых представляет собой физическую величину разного типа.
| Название агрегата | Условное обозначение | Кол-во наименование | Условное обозначение | Обозначение размеров |
|---|---|---|---|---|
| метр | м | длина | л , x , r | л |
| килограмм | кг | масса | м | M |
| второй | с | раз | т | Т |
| ампер | A | электрический ток | Я | я |
| кельвин | К | термодинамическая температура | т | Θ |
| кандела | кд | сила света | Я v | Дж |
| моль | моль | количество вещества | n | N |
Производные единицы
Производные единицы не ограничены по количеству и образуются путем умножения и деления семи основных единиц и других производных единиц; Например, производная единица измерения скорости в системе СИ — метры в секунду, м / с.{-2} [/ латекс]
В химии более принято выражать давление в атмосферных единицах или торр:
1 атм = 101325 Па = 760 торр [латекс] \ приблизительно [/ латекс] 760 мм рт. Ст.
Торр и миллиметры ртутного столба (мм рт. Ст., Определяемые как разница в один миллиметр в высоте ртутного барометра при 0 ° C) почти эквивалентны. Еще одна единица измерения давления, используемая в метеорологии, — это бар:
.1 бар = 105 Н / м 2 = 750,06 торр = 0,987 атм.
Поскольку измеряемые величины могут иметь такой широкий диапазон, была установлена стандартизированная система префиксов.
Стандартные префиксы для единиц СИ. : Префикс может быть добавлен к имени единицы для описания кратной исходной единицы.
Это позволяет нам легко записывать очень маленькие и очень большие числа, такие как 1 мПа (миллипаскаль, 10 -3 ) или 1 ГПа (гигапаскаль, 10 9 , e.).
Давление может быть представлено множеством различных единиц и префиксов. При выполнении расчетов давления важно убедиться, что все размеры указаны в одной системе единиц.
Пример 1
В данный день атмосферное давление составляет 770 мм рт. Какое давление в паскалях?
[латекс] \ text {770 мм рт. Ст.} \ Times \ frac {\ text {101,3 Па}} {\ text {760 мм рт. Ст.}} = \ Text {102,6 Па} [/ латекс]
Давление 102,6 Па.
Давление газа: основы — YouTube : Что означает давление? Как возникает давление газа? Как можно измерить давление? манометр барометр мм рт. ст. атм кПа единицы кинетическая молекулярная теория
Физические и химические свойства вещества
Цель обучения
- Признать разницу между физическими и химическими, интенсивными и обширными свойствами
Ключевые моменты
- Все свойства вещества являются либо физическими, либо химическими, а физические свойства либо интенсивными, либо обширными.
- Обширные свойства, такие как масса и объем, зависят от количества измеряемого вещества.
- Интенсивные свойства, такие как плотность и цвет, не зависят от количества присутствующего вещества.
- Физические свойства можно измерить без изменения химической идентичности вещества.
- Химические свойства можно измерить только путем изменения химической идентичности вещества.
Условия
- обширное свойство Любая характеристика вещества, зависящая от количества измеряемого вещества.
- химическое свойство: Любая характеристика, которая может быть определена только путем изменения молекулярной структуры вещества.
- интенсивное свойство: Любая характеристика вещества, не зависящая от количества присутствующего вещества.
- физическое свойство: Любая характеристика, которая может быть определена без изменения химической идентичности вещества.
Все свойства материи являются экстенсивными или интенсивными, физическими или химическими. Обширные свойства, такие как масса и объем, зависят от количества измеряемого вещества.Интенсивные свойства, такие как плотность и цвет, не зависят от количества вещества. И экстенсивные, и интенсивные свойства являются физическими свойствами, что означает, что их можно измерить без изменения химической идентичности вещества. Например, точка замерзания вещества является физическим свойством: когда вода замерзает, это неподвижная вода (H 2 O) — просто она находится в другом физическом состоянии.
Твердое тело, жидкости и газы Вода может существовать в нескольких состояниях, включая лед (твердое тело), воду (жидкость) и водяной пар (газ).Между тем, химическое свойство — это любое свойство материала, которое проявляется в ходе химической реакции; то есть любое качество, которое может быть установлено только путем изменения химической идентичности вещества. Химические свойства нельзя определить, просто взглянув на вещество или прикоснувшись к нему; Чтобы исследовать химические свойства вещества, необходимо повлиять на его внутреннюю структуру.
Физические свойства
Физические свойства — это свойства, которые можно измерить или наблюдать без изменения химической природы вещества.Некоторые примеры физических свойств:
- цвет (интенсивный)
- плотность (интенсивная)
- том (обширный)
- масса (обширная)
- точка кипения (интенсивная): температура, при которой вещество закипает
- точка плавления (интенсивная): температура плавления вещества
Химические свойства
Помните, определение химического свойства заключается в том, что измерение этого свойства должно приводить к изменению химической структуры вещества. Вот несколько примеров химических свойств:
- Теплота сгорания — это энергия, выделяющаяся при полном сгорании (сгорании) соединения с кислородом. Обозначение теплоты сгорания ΔH c .
- Химическая стабильность означает, будет ли соединение реагировать с водой или воздухом (химически стабильные вещества не вступают в реакцию).Гидролиз и окисление — две такие реакции, обе представляют собой химические изменения.
- Воспламеняемость означает, будет ли соединение гореть под воздействием огня. Опять же, горение — это химическая реакция, обычно высокотемпературная реакция в присутствии кислорода.
- Предпочтительная степень окисления — это степень окисления с наименьшей энергией, для достижения которой металл будет подвергаться реакциям (если присутствует другой элемент, принимающий или отдающий электроны).
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Физические и химические свойства вещества
1.5: Физические и химические свойства вещества
Характеристики, позволяющие отличить одно вещество от другого, называются свойствами.
Физические свойства вещества
Физическое свойство — это характеристика вещества, не связанная с изменением его химического состава.Знакомые примеры физических свойств включают плотность, цвет, твердость, точки плавления и кипения, а также электропроводность. Мы можем наблюдать некоторые физические свойства, такие как плотность и цвет, без изменения физического состояния наблюдаемой материи. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения.
Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения ее химического состава (идентичности веществ, содержащихся в материи).Мы наблюдаем физические изменения, когда, например, воск плавится, сахар растворяется в кофе, а пар конденсируется в жидкую воду. Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых тел в порошки. В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменяется его химический состав.
Химические свойства вещества
Превращение одного типа материи в другой (или неспособность к изменению) является химическим свойством.Примеры химических свойств включают воспламеняемость, токсичность, кислотность, реакционную способность (многие типы) и теплоту сгорания. Железо, например, соединяется с кислородом в присутствии воды с образованием ржавчины; хром не окисляется. Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень инертен.
Чтобы определить химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения.Образование ржавчины — это химическое изменение, потому что ржавчина — это другой тип вещества, чем железо, кислород и вода, присутствовавшие до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, потому что образующиеся газы представляют собой вещества, очень отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, которые проводятся в лаборатории (например, взаимодействие меди с азотной кислотой), все формы горения (горения), созревание фруктов и приготовление, переваривание или гниение пищи.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 1.3: Физические и химические свойства.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.
 плотность
плотность
