Опровергнута самая популярная теория строения воды
Учёные СФУ совместно с коллегами из Королевского института технологий Швеции опровергли самую популярную ныне кластерную теорию строения воды. В ходе работы исследователи предложили новую теорию, согласующуюся с результатами их эксперимента. Работа опубликована в журнале Nature Communications. Исследования поддержаны грантом Российского научного фонда.
Вода — одно из самых распространённых, но в то же время необычных веществ на Земле. Она обладает рядом нетипичных свойств, объясняемых её особой структурой, например, высокой теплоёмкостью и низкой электропроводностью. Общепринято, что вода состоит из молекул Н2О, объединённых в группы так называемыми водородными связями. Их наличие обусловлено притяжением между положительно заряженными атомами водорода и отрицательно заряженными атомами кислорода. Свободные, не входящие в кластеры (группы молекул, связанных водородными связями) молекулы присутствуют лишь в небольшом количестве.
Чтобы пролить свет на эту фундаментальную проблему, авторы работы провели эксперимент с парами воды, где нет водородных связей. В ходе исследования они измерили спектр резонансного неупругого рассеяния изолированной молекулы. Эксперименты привели к неожиданному результату и показали, что точно такое же расщепление резонанса на два пика присутствует в рентгеновских спектрах рассеяний молекул воды в газовой фазе. Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.
Более того, выполненные теоретические расчёты однозначно объясняют расщепление на спектре сверхбыстрым распадом (диссоциацией) молекулы воды на ионы Н+ и ОН-. Таким образом, исследование свидетельствует о динамической природе расщепления резонанса и опровергает структурный механизм, тем самым демонстрируя, что структура воды однородна.
Второй не менее важный результат этой работы — получение детальной структурной информации о том, как влияют водородные связи на силу OH-связи. Колебательная инфракрасная (ИК) спектроскопия — общепринятый инструмент для исследования водородных связей в жидкостях. Но в них ИК-спектроскопия показывает лишь наиболее интенсивный переход в состояние с минимальной энергией колебаний, которое «слабо чувствует» межмолекулярное взаимодействие. Спектроскопия резонансного неупругого рассеяния воды качественно отличается от ИК-спектроскопии тем, что, получив энергию от рентгеновского фотона, электрон кислорода переходит с самой глубокой орбитали на первую незанятую.
«Важно отметить, что, в отличие от изолированной молекулы воды с одной энергией взаимодействия О и Н, в жидкости имеется набор (распределение) таких энергий в силу многообразия ближайшего окружения молекулы воды.Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,
— дополняет Фарис Гельмуханов, доктор физико-математических наук, профессор Королевского технологического института (Стокгольм, Швеция), старший научный сотрудник Сибирского федерального университета.
В работе также приняли участие учёные из Университета Потсдама (Германия), Университета Цюриха (Швейцария) и Университета Турку (Финляндия).
Рисунки
- A) Молекула воды, поглотив фотон, возбуждается из основного состояния (0) в высоковозбуждённое диссоциативное состояние (с), где атом водорода быстро покидает точку равновесия.
 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно. - Б) рентгеновский спектр поглощения воды.
- B) Спектры испускания c→f и c→0 вблизи 526 эВ и 535 эВ, соответственно. Эмиссионный спектр c→f вблизи 525 эВ показывает динамическое формирование (в процессе диссоциации) дублета с расщеплением Δ (см. панель A). При возвращении молекулы в основное состояние c→0 в процессе диссоциации заселяются высокие колебательные уровни, что формирует протяжённую колебательную прогрессию в районе 535 эВ.
- Г) В работе решена обратная задача восстановления из колебательной прогрессии распределения OH-потенциалов воды в жидкой фазе.
Пресс-служба РНФ, пресс-служба СФУ,
ЖИЗНЬ, МОЛЕКУЛА ВОДЫ И ЗОЛОТАЯ ПРОПОРЦИЯ
Соотношения золотой пропорции исследователи находят в морфологической структуре растений, птиц, животных, человека.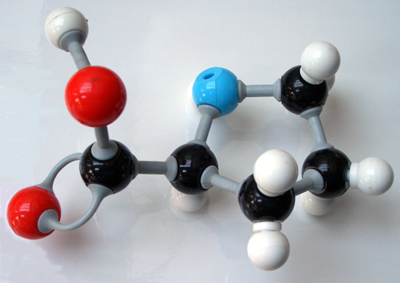
Наука и жизнь // Иллюстрации
Теплоемкость воды достигает минимального значения при температуре около 37<SUP>о</SUP>С.
Наука и жизнь // Иллюстрации
Илл. 1. Плотность воды при понижении температуры сначала возрастает, достигает максимума при 4<SUP>о</SUP>С и начинает уменьшаться.
Наука и жизнь // Иллюстрации
В момент плавления объем свинца мгновенно увеличивается от 1 до 1,003, а объем воды скачком уменьшается от 1,1 до 1,0.
Наука и жизнь // Иллюстрации
Вода имеет аномально высокие температуры кипения и замерзания по сравнению с другими трехатомными соединениями водорода.
Наука и жизнь // Иллюстрации
В жидкой воде молекулы H<SUB>2</SUB>O могут объединяться в сложные образования — кластеры, по структуре напоминающие лед.
Наука и жизнь // Иллюстрации
Схематичное изображение молекулы воды на плоскости.
Деление отрезка в крайнем и среднем отношении, или золотая пропорция. Отрезок разделен на две части так, что CB:AC = AC:AB.
«Золотой треугольник». Соотношение его сторон OA:AB = OB:AB ≈ 0,618,
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
Воде была дана волшебная власть стать соком жизни на Земле.
Леонардо да Винчи
Вода — одно из самых уникальных и загадочных веществ на Земле. Природа этого вещества до конца еще не понята. Внешне вода кажется достаточно простой, в связи с чем долгое время считалась неделимым элементом.
Дальнейшие исследования показали, что за незатейливой химической формулой Н
Загадочная магия воды. Почему жидкая вода имеет необычные свойства? Традиционный ответ может быть следующим: из-за свойств атомов кислорода и водорода, из-за их структурного расположения в молекуле, из-за определенного поведения электронов в молекуле и т. п.
п.
Так в чем же заключаются загадочные, необычные свойства привычной всем жидкой воды? Прежде всего, в том, что практически все свойства воды аномальны, а многие из них не подчиняются логике тех законов физики, которые управляют другими веществами. Кратко упомянем те из них, которые обуславливают существование жизни на Земле.
Вначале о трех особенностях тепловых свойств воды.
Первая особенность: вода — единственное вещество на Земле (кроме ртути), для которого зависимость удельной теплоемкости от температуры имеет минимум.
Из-за того, что удельная теплоемкость воды имеет минимум около 37оС, нормальная температура человеческого тела, состоящего на две трети из воды, находится в диапазоне температур 36-38оС (внутренние органы имеют более высокую температуру, чем наружные).
Вторая особенность: теплоемкость воды аномально высока. Чтобы нагреть определенное ее количество на один градус, необходимо затратить больше энергии, чем при нагреве других жидкостей, — по крайней мере вдвое по отношению к простым веществам. Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Из этого вытекает уникальная способность воды сохранять тепло. Подавляющее большинство других веществ таким свойством не обладают. Эта исключительная особенность воды способствует тому, что у человека нормальная температура тела поддерживается на одном уровне и жарким днем, и прохладной ночью.
Таким образом, вода играет главенствующую роль в процессах регулирования теплообмена человека и позволяет ему поддерживать комфортное состояние при минимуме энергетических затрат. При нормальной температуре тела человек находится в наиболее выгодном энергетическом состоянии.
Температура других теплокровных млекопитающих (32-39оС) также хорошо соотносится с температурой минимума удельной теплоемкости воды.
Третья особенность: вода обладает высокой удельной теплотой плавления, то есть воду очень трудно заморозить, а лед — растопить. Благодаря этому климат на Земле в целом достаточно стабилен и мягок.
Все три особенности тепловых свойств воды позволяют человеку оптимальным образом существовать в условиях благоприятной среды.
Имеются особенности и в поведении объема воды. Плотность большинства веществ — жидкостей, кристаллов и газов — при нагревании уменьшается и при охлаждении увеличивается, вплоть до процесса кристаллизации или конденсации. Плотность воды при охлаждении от 100 до 4оС (точнее, до 3,98оС) возрастает, как и у подавляющего большинства жидкостей. Однако, достигнув максимального значения при температуре 4оС, плотность при дальнейшем охлаждении воды начинает уменьшаться. Другими словами, максимальная плотность воды наблюдается при температуре 4оС (одна из уникальных аномалий воды), а не при температуре замерзания 0оС.
Замерзание воды сопровождается скачкообразным(!) уменьшением плотности более чем на 8%, тогда как у большинства других веществ процесс кристаллизации сопровождается увеличением плотности. В связи с этим лед (твердая вода) занимает больший объем, чем жидкая вода, и держится на ее поверхности.
Столь необычное поведение плотности воды крайне важно для поддержания жизни на Земле.
Покрывая воду сверху, лед играет в природе роль своего рода плавучего одеяла, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Отметим еще некоторые особенности воды.
Внешне вода подвижна и податлива, и ее можно заключить в любой сосуд. Однако, проникая в трещины горных пород и расширяясь при замерзании, вода раскалывает скальные породы любой твердости, которые постепенно распадаются на все более мелкие частицы. Так начинается возврат окаменевших пород в жизненный цикл: на полях промерзание поверхностных слоев земли с ее органическими компонентами помогает образованию плодородной почвы.
Процесс включения твердых веществ в большой круговорот живой природы ускоряется чудесным свойством воды их растворять. Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода с растворенными компонентами твердых веществ становится средой питания и поставщиком микроэлементов, необходимых для жизни растений, животных и человека.
Вода сильнее других жидкостей проявляет свойства универсального растворителя. Если ей дать достаточно времени, она может растворить практически любое твердое вещество. Именно из-за уникальной растворяющей способности воды никому до сих пор не удалось получить химически чистую воду — она всегда содержит растворенный материал сосуда. Вода абсолютно необходима для всех ключевых систем жизнеобеспечения человека. Она содержится в человеческой крови (79%) и способствует переносу по кровеносной системе в растворенном состоянии тысяч необходимых для жизни веществ. Вода содержится в лимфе (96%), которая разносит из кишечника питательные вещества по тканям живого организма (см. таблицу 1).
Перечисленные свойства и особая роль воды в обеспечении жизни на Земле не могут оставить равнодушным ни один пытливый ум, даже если он верит в счастливые случайности. «Начало всего есть вода», — справедливо отмечал Фалес из Милета в VI веке до н.э.
«Начало всего есть вода», — справедливо отмечал Фалес из Милета в VI веке до н.э.
Жидкое чудо. Прекратим перечисление странных, но жизненно необходимых свойств воды, которых можно набрать еще с десяток, и переключим внимание на секреты необычного строения ее молекулы. Именно анализ строения молекулы воды позволяет понять ее исключительность в живой и неживой природе. Так что дорога к истине проходит через строение одиночной молекулы воды.
Прежде всего отметим, что молекула воды самая маленькая среди подобных трехатомных молекул (по отношению к гомологам, то есть водородным соединениям типа Н2S, Н2Se, Н2Те, со свойствами которых традиционно сравнивают свойства воды). Такие молекулы при нормальных условиях образуют газы, а молекулы воды — жидкость. Почему?
Хаотичное сообщество газообразных молекул воды при конденсации, то есть при образовании жидкой фазы, формирует жидкое вещество удивительной сложности. В первую очередь это связано с тем, что молекулы воды обладают уникальным свойством объединяться в кластеры (группы) (Н2О)x. Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
Под кластером обычно понимают группу атомов или молекул, объединенных физическим взаимодействием в единый ансамбль, но сохраняющих внутри него индивидуальное поведение. Возможности прямого наблюдения кластеров ограничены, и поэтому экспериментаторы компенсируют аппаратурные недостатки интуицией и теоретическими построениями.
При комнатной температуре степень ассоциации X для воды составляет, по современным данным, от 3 до 6. Это означает, что формула воды не просто Н2О, а среднее между Н6О3 и Н12О6. Другими словами, вода — сложная жидкость, «составленная» из повторяющихся групп, содержащих от трех до шести одиночных молекул. Вследствие этого вода имеет аномальные значения температуры замерзания и кипения по сравнению с гомологами. Если бы вода подчинялась общим правилам, она должна была замерзать при температуре порядка -100оС и закипать при температуре около +10оС.
Если бы вода при испарении оставалась в виде Н6О3, Н8О4 или Н12О6, то водяной пар был бы намного тяжелее воздуха, в котором доминируют молекулы азота и кислорода. В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
В этом случае поверхность всей Земли была бы покрыта вечным слоем тумана. Представить себе жизнь на такой планете практически невозможно.
Людям крупно повезло: кластеры воды при испарении распадаются, и вода превращается практически в простой газ с химической формулой Н2О (обнаруженное в последнее время в паре незначительное количество димеров Н4О2 погоды не делает). Плотность газообразной воды меньше плотности воздуха, и поэтому вода способна насыщать своими молекулами земную атмосферу, создавая комфортные для человека погодные условия.
На Земле нет других веществ, наделенных способностью быть жидкостью при температурах существования человека и при этом образовывать газ не только легче воздуха, но и способный возвращаться к ее поверхности в виде осадков.
Восхитительная геометрия. Итак, какова же самая маленькая среди трехатомных
молекул? Молекула воды имеет симметричную V-образную форму, так как два небольших
атома водорода располагаются с одной стороны от сравнительно крупного атома
кислорода.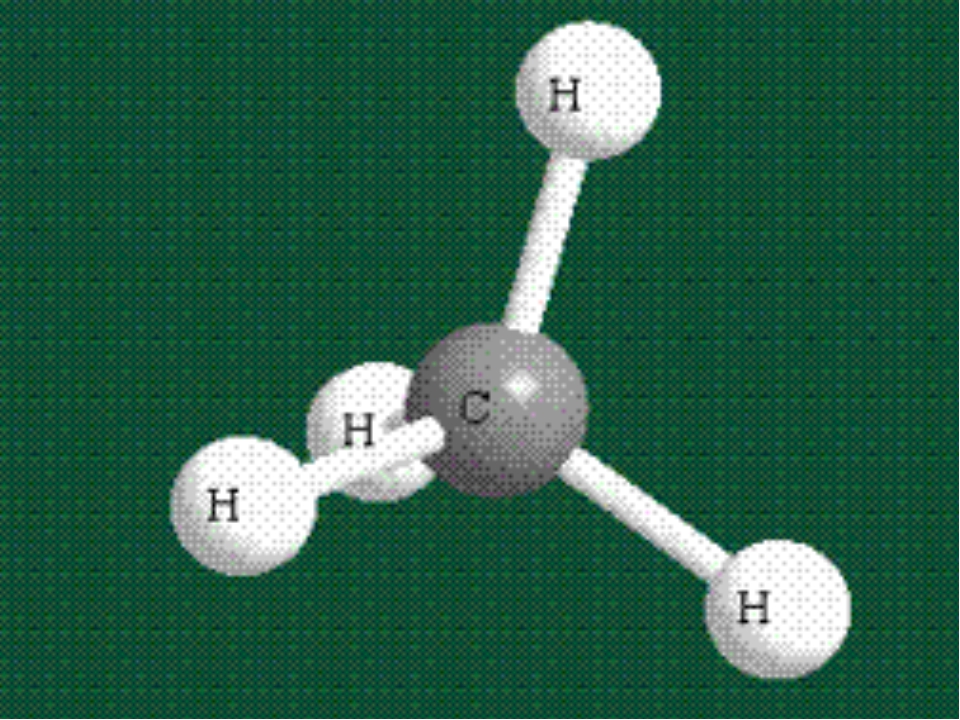 Это сильно отличает молекулу воды от линейных молекул, например Н2Ве,
в которой все атомы располагаются цепочкой. Именно такое странное расположение
атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Это сильно отличает молекулу воды от линейных молекул, например Н2Ве,
в которой все атомы располагаются цепочкой. Именно такое странное расположение
атомов в молекуле воды и позволяет ей иметь множество необычных свойств.
Если внимательно рассмотреть геометрические параметры молекулы воды, то в ней обнаруживается определенная гармония. Чтобы увидеть ее, построим равнобедренный треугольник Н-О-Н с протонами в основании и кислородом в вершине. Такой треугольник схематично копирует структуру молекулы воды, проекция которой на плоскость условно изображена на рисунке.
Длины сторон этого треугольника и валентный угол между двумя связями О-Н изменяются при изменении агрегатного состояния воды. Приведем эти параметры (см. таблицу 2).
Прокомментируем данные, характеризующие различные состояния воды.
Параметры молекулы воды в парообразном состоянии получены на основе обработки спектров ее поглощения. Результаты неоднократно уточнялись, но по существу правильно оценивают длины связей и валентный угол в молекуле воды в состоянии пара.
Кристаллическая структура льда при нормальном давлении довольно рыхлая с причудливой паутиной связей между молекулами воды. Схематично кристаллическую решетку обычного льда можно построить из атомов кислорода, каждый из которых участвует с соседними атомами в четырех водородных связях, направленных приблизительно к вершинам правильного тетраэдра.
Напомним, что водородной называется связь между атомами в одной молекуле или между соседними молекулами, которая осуществляется через атом водорода. Водородная связь играет чрезвычайно важную роль в структуре не только воды, но и большинства биологических молекул — углеводов, белков, нуклеиновых кислот и т. п.
Если кристаллический лед хорошо упорядочен по кислороду, то этого нельзя сказать про водород: в расположении ионов водорода (протонов) наблюдается сильный беспорядок. Их положение четко не определено, и поэтому лед можно считать разупорядоченным по водороду.
Лед обладает многими удивительными особенностями, из которых отметим две.
Во-первых, он всегда очень чист химически. В структуре льда практически не бывает примесей: при замерзании они вытесняются в жидкость. Именно поэтому снежинки всегда белые, а льдинки на поверхности грязной лужи практически прозрачные. Вообще говоря, любой растущий кристалл стремится создать идеальную кристаллическую решетку и вытесняет посторонние вещества. Но в планетарном масштабе именно замечательный феномен замерзания и таяния воды играет роль гигантского очистительного процесса — вода на Земле постоянно очищает сама себя.
Во-вторых, лед и особенно снег обладают очень высокой отражательной способностью. Благодаря этому солнечное излучение не вызывает заметного нагрева полярных областей, и, как следствие этого, наша планета избавлена от сезонных наводнений и повышений уровня Мирового океана.
Экспериментальное определение параметров одиночной молекулы воды в жидкой фазе до сих пор встречает непреодолимые трудности, поскольку жидкая вода — это смесь структурных элементов, то есть различных кластеров, находящихся в динамическом равновесии между собой. Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: «простая» жидкость Н2О не торопится раскрывать свои внутренние секреты.
Полной ясности в отношении их взаимодействий до сих пор нет, а разделить такую смесь на отдельные компоненты невозможно: «простая» жидкость Н2О не торопится раскрывать свои внутренние секреты.
Вернемся к рисунку, на котором в общих чертах представлена структура молекулы воды. В ней есть симметрия, которая играет основную роль в попытках всестороннего объяснения физического мира, и асимметрия, наделяющая эту молекулу возможностью движения и связью с золотой пропорцией. Поэтому кратко напомним о том, что в математике называют золотой пропорцией.
Золотая пропорция . Это понятие возникает при решении геометрической задачи о нахождении на отрезке АВ такой точки С, чтобы выполнялось соотношение СВ:АС = АС:АВ.
Решение этой задачи приводит к отношению СВ:АС = (-1+√5)/2, которое называют золотой пропорцией, а соответствующее геометрическое деление отрезка АВ точкой С называют золотым сечением. Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Если принять весь отрезок за единицу, то АС = 0,618033… и СВ = 0,381966….
Время показало, что золотая пропорция воплощает совершенные и гармоничные отношения двух величин. В геометрической интерпретации она приводит к соразмерному и привлекательному соотношению между двумя неравными отрезками.
Исследователи золотой пропорции с античных времен до наших дней всегда восхищались и продолжают восхищаться ее свойствами, которые проявляются в строении различных элементов физического и биологического мира. Золотая пропорция обнаруживается везде, где соблюдены принципы гармонии.
Что же объединяет золотую пропорцию с молекулой воды? Чтобы ответить на этот вопрос, рассмотрим двумерный образ золотой пропорции в виде треугольника.
В золотом треугольнике отношение ОА:АВ = ОВ:АВ приблизительно равно 0,618,
угол α = 108,0о. Для льда отношение длин связей О-Н к Н-Н равно 0,100:0,163
= 0,613 и угол α = 109,5о, для пара — соответственно 0,631 и 104,5о. Не распознать в золотом треугольнике прообраз структуры молекулы воды просто
невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность
подобной интерпретации ее строения.
Не распознать в золотом треугольнике прообраз структуры молекулы воды просто
невозможно! Удивительно, что до сих пор так мало внимания обращали на возможность
подобной интерпретации ее строения.
И действительно, поместив в треугольнике АОВ в точки А и В атомы водорода, а в точку О — атом кислорода, получим в первом приближении молекулу жидкой воды, сконструированную на основе золотой пропорции. Подобная элегантность молекулы очаровывает и восхищает. Так что роль молекулы воды в природе и жизни не может быть правильно оценена без учета красоты ее формы.
Исключительная гармония. Убедимся, что молекула жидкой воды — единственное трехатомное вещество, имеющее соразмерности, свойственные золотой пропорции.
В трехатомных молекулах-гомологах, близких по химическому составу к молекуле воды (Н2S, H2Se и Н2Те), валентный угол приблизительно равен 90о. Например, молекула Н2S имеет следующие геометрические параметры:
длина связи S-Н, нм . …………………… 0,1345
…………………… 0,1345
длина связи Н-Н, нм ……………………… 0,1938
валентный угол Н-S-Н, град ………….. 92,2
Отношение длин связей S-Н к Н-Н равно 0,694, что далеко от золотой пропорции. Квантово-химические расчеты показывают, что если бы вода была подобна родственным ей веществам, то валентный угол у ее молекулы должен был быть приблизительно таким же, как у Н2S, или больше максимум на 5о.
Но вода, как выясняется, не любит подобия, она всегда герой другого романа. Если бы валентный угол у воды был порядка 90-95о, о золотой пропорции пришлось бы забыть и вода оказалась бы в одном содружестве с другими водородными соединениями.
Но вода уникальна, ее молекула обладает практически выверенными эстетическими качествами, и поэтому ее свойства необходимо иногда интерпретировать, выходя за рамки традиционной научной парадигмы. И тогда некоторые загадки воды смогут быть объяснены таким «ненаучным» понятием, как гармония.
На приведенные рассуждения можно возразить: экспериментальные измерения геометрических параметров молекулы воды имеют определенную погрешность, и поэтому соотношение золотой пропорции может строго не выполняться. Но даже если в экспериментальные измерения внести еще большую погрешность, молекула воды все равно останется единственным из трехатомных веществ, имеющим практически «золотые» гармоничные пропорции.
В связи с этим обратим внимание на загадку талой воды, которая, по широко распространенному мнению, обладает отличным от обычной воды физиологическим воздействием.
Удивительная талая вода. Она рождается при таянии льда и сохраняет температуру 0оС, пока весь лед не растает. Специфика межмолекулярных взаимодействий, характерная для структуры льда, сохраняется и в талой воде, так как при плавлении кристалла разрушается только 15% всех водородных связей. Поэтому присущая льду связь каждой молекулы воды с четырьмя соседними («ближний порядок») в значительной степени не нарушается, хотя и наблюдается бoльшая размытость кислородной каркасной решетки.
Таким образом, талая вода отличается от обычной изобилием многомолекулярных кластеров, в которых в течение некоторого времени сохраняются рыхлые льдоподобные структуры. После таяния всего льда температура воды повышается и водородные связи внутри кластеров перестают противостоять возрастающим тепловым колебаниям атомов. Размеры кластеров изменяются, и поэтому начинают меняться свойства талой воды: диэлектрическая проницаемость приходит к своему равновесному состоянию через 15-20 минут, вязкость — через 3-6 суток. Биологическая активность талой воды спадает, по одним данным, приблизительно за 12-16 часов, по другим — за сутки.
Итак, физико-химические свойства талой воды самопроизвольно меняются во времени, приближаясь к свойствам обычной воды: она постепенно как бы «забывает» о том, что еще недавно была льдом.
Лед и пар — различные агрегатные состояния воды, и поэтому логично предположить, что в жидкой промежуточной фазе валентный угол отдельной молекулы воды лежит в диапазоне между значениями в твердой фазе и в паре. В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
В кристалле льда валентный угол молекулы воды близок к 109,5о. При таянии льда межмолекулярные водородные связи ослабевают, расстояние Н-Н несколько сокращается, валентный угол уменьшается. При нагревании жидкой воды происходит разупорядочение кластерной структуры, и этот угол продолжает уменьшаться. В парообразном состоянии валентный угол молекулы воды составляет уже 104,5о.
Значит, для обычной жидкой воды валентный угол вполне может иметь некоторое среднее значение между 109,5и 104,5о, то есть примерно 107,0о. Но так как талая вода по своей внутренней структуре близка ко льду, то и валентный угол ее молекулы должен быть ближе к 109,5о, скорее всего, около 108,0о.
Сказанное выше можно сформулировать в виде гипотезы: в силу того, что талая вода значительно более структурирована, чем обычная вода, ее молекула с большой долей вероятности имеет структуру, максимально приближенную к гармоничному треугольнику золотой пропорции с валентным углом, близким к 108о, и с отношением длин связей примерно 0,618-0,619.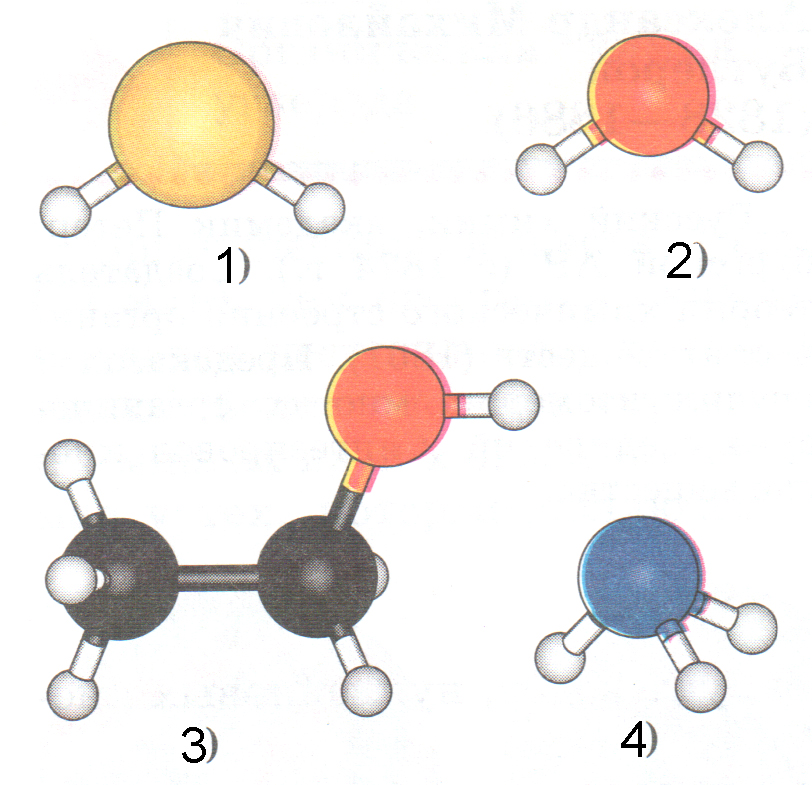
Экспериментального подтверждения этой гипотезы у авторов нет, как нет и какой-либо теории ее обоснования. Есть только догадка, высказанная на этих страницах, которая может, естественно, оспариваться.
Таинственная сила талой воды. Человеку с незапамятных времен известны удивительные свойства талой воды. Давно замечено, что вблизи тающих родников растительность альпийских лугов всегда пышнее, а у кромки тающего льда в арктических морях бурно цветет жизнь. Полив талой водой повышает урожайность сельскохозяйственных культур, ускоряет прорастание семян. При употреблении талой воды устойчиво повышаются привесы в животноводстве, ускоряется развитие цыплят. Известно, с какой жадностью животные пьют весной талую воду, а птицы буквально купаются в первых лужицах подтаявшего снега.
Талая вода, в отличие от обычной, по своей структуре очень похожа на жидкость, содержащуюся в клетках растительных и живых организмов. Именно поэтому для человека более подходит «ледяная» структура талой воды, в которой молекулы объединены в ажурные кластеры. Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты — они доставляют в организм воду, имеющую аналогичную структуру.
Это уникальное свойство талой воды способствует ее легкому усвоению организмом, она биологически активна. Вот почему так полезны овощи и фрукты — они доставляют в организм воду, имеющую аналогичную структуру.
При питье талой воды происходит подпитка организма самым гармоничным из всех веществ на Земле. Она улучшает обмен веществ и усиливает кровообращение, снижает количество холестерина в крови и успокаивает боли в сердце, повышает адаптационные возможности организма и способствует продлению жизни. Глоток чистейшей талой воды тонизирует лучше пастеризованного сока, в ней есть заряд энергии, бодрости и легкости.
Один из авторов этой работы постоянно пьет талую с плавающими льдинками воду и считает, что именно поэтому за три года ни разу не простудился. Талая вода освежает и молодит кожу, которая перестает нуждаться в кремах и лосьонах.
Теоретическое изучение свойств талой воды находится пока на уровне гипотез. Нет общепринятого мнения о причинах, вызывающих необычные эффекты при ее применении. Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности — все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Есть определенные проблемы и с доказательной стороной биологической активности талой воды. Исследования в этом направлении вызывают порой жаркие дискуссии. Сложность проблемы, отсутствие ясности — все это должно не отпугивать, а притягивать и способствовать появлению новых идей, гипотез, теорий. Таков зачастую тернистый путь развития науки.
Подчеркнем: приведенная гипотеза не претендует на расшифровку загадки талой воды. Она лишь позволяет выйти за рамки традиционного мышления и посмотреть на взаимную любовь жизни и воды с необычной стороны — со стороны гармонии и красоты, со стороны особых свойств талой воды, добавляющих ее изящной молекуле черты, которыми не обладают другие молекулы.
ЛИТЕРАТУРА
Ауэрбах Ф. Семь аномалий воды. — СПб., 1919.
Габуда С. П. Связанная вода. Факты и гипотезы. — Новосибирск: Наука, 1982.
Зацепина Г. Н. Физические свойства и структура воды. — М.: МГУ, 1998.
Синюков В. В. Вода известная и неизвестная. — М.: Знание, 1987.
— М.: Знание, 1987.
Белянин В. С., Романова Е. Золотая пропорция. Новый взгляд // Наука и жизнь, 2003, № 6.
Вода: структура, состояние, сольватизация. Достижения последних лет. — М.: Наука, 2003.
Подписи к иллюстрациям
Илл. 1. Плотность льда почти на 10% меньше, чем у воды, а удельный объем на столько же больше. Поэтому лед плавает, а вода, замерзая в трещинах горных пород, раскалывает их.
Элементы жизни. Вода — Индикатор
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины.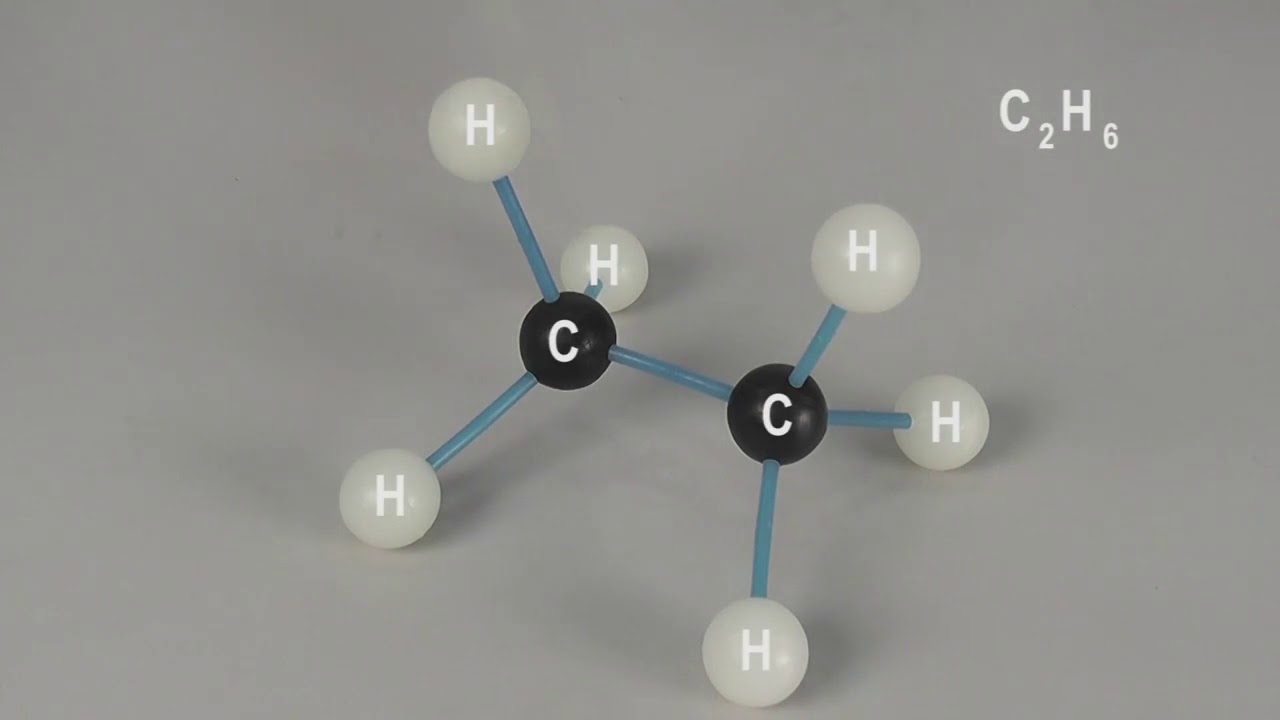 В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно. Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно. Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям прежде всего в виде углекислого газа, который мы выдыхаем, но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы. Например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых суперземлях — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода, ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем. Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Как слепить молекулы из пластилина.
Многие школьники не любят химию и считают ее скучным предметом. Многим этот предмет дается с трудом. Но ее изучение может быть интересным и познавательным, если подойти к процессу творчески и показать все наглядно.
Предлагаем вам подробное руководство по лепке молекул из пластилина.
Перед изготовлением молекул нам нужно заранее определиться с тем, какие химические формулы будем использовать. В нашем случае это этан, этилен, метилен. Нам понадобятся: пластилин контрастных цветов (в нашем случае – красный и синий) и немного зеленого пластилина, спички (зубочистки).
В нашем случае это этан, этилен, метилен. Нам понадобятся: пластилин контрастных цветов (в нашем случае – красный и синий) и немного зеленого пластилина, спички (зубочистки).
1. Из красного пластилина скатываем 4 шарика диаметром около 2 см (атомы углерода). Затем из синего пластилина скатываем 8 шариков поменьше, диаметром около сантиметра (атомы водорода).
2. Берем 1 красный шарик и вставляем в него 4 спички (или зубочистки)так, как показано на рисунке.
3. Берем 4 синих шарика и надеваем их на свободные концы вставленных в красный шарик спичек. Получилась молекула природного газа.
4. Повторяем шаг №3 и получаем две молекулы для следующего химического вещества.
5. Сделанные молекулы нужно соединить между собой спичкой для того, чтобы получилась молекула этана.
6. Также можно создать молекулу с двойной связью — этилен. Для этого, из каждой молекулы, полученной при выполнении шага № 3 вынимаем по 1 спичке с надетым на нее синим шариком и соединяем детали между собой двумя спичками.
7. Берем красный шарик и 2 синих и соединяем их между собой двумя спичками так, чтобы получилась цепочка: синий – 2 спички – красный – 2 спички – синий. У нас получилась еще одна молекула с двойной связью – метилен.
8. Берем оставшиеся шарики: красный и 2 синих и соединяем их спичками между собой как показано на рисунке. Затем скатываем из зеленого пластилина 2 маленьких шарика и прикрепляем к нашей молекуле. У нас получилась молекула с двумя отрицательно заряженными электронами.
Изучение химии станет интереснее, а у вашего ребенка появится интерес к предмету.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Олеся Селихова
Об авторе: Психолог, специалист в области семейных отношений и воспитания детей. Обожаю рисование, лепку, рукоделие и любое интересное творчество. Мама, воспитывающая двоих детей и прекрасная жена!
Вывести на чистую воду: как работает система опреснения
Ни для кого не секрет, что на нашей планете больше воды, чем суши – свыше двух третей поверхности Земли покрыто водой.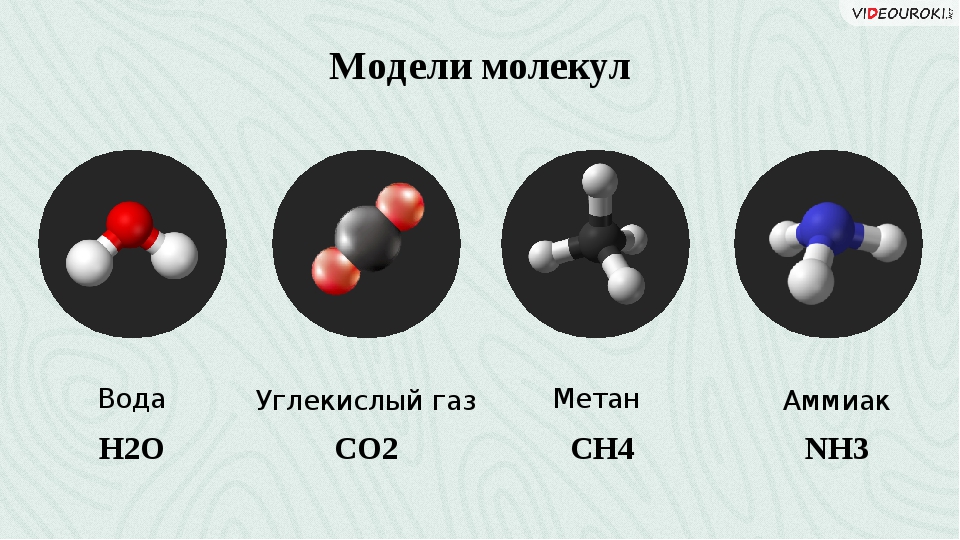 Но, пожалуй, для многих станет неожиданным тот факт, что менее трех процентов этого огромного количества воды является пресной. В некоторых засушливых регионах планеты приходится в буквальном смысле бороться за каждый литр воды. Сегодня в таких странах все чаще применяют промышленное опреснение. Для этого существуют различные современные методы, один из самых распространенных – обратный осмос. Именно так устроена новейшая система опреснения морских и океанических вод холдинга «Швабе». Рассказываем, как вода из соленой превращается в пресную.
Но, пожалуй, для многих станет неожиданным тот факт, что менее трех процентов этого огромного количества воды является пресной. В некоторых засушливых регионах планеты приходится в буквальном смысле бороться за каждый литр воды. Сегодня в таких странах все чаще применяют промышленное опреснение. Для этого существуют различные современные методы, один из самых распространенных – обратный осмос. Именно так устроена новейшая система опреснения морских и океанических вод холдинга «Швабе». Рассказываем, как вода из соленой превращается в пресную.
Пресная вода: как капля в море
По подсчетам ученых, на Земле примерно 1,5 зетталитров воды. При этом запасы пресной воды составляют лишь 2,5% от этого объема. Более наглядно это можно изобразить так: если вся вода на нашей планете поместится в литровую банку, то только две столовые ложки воды из этой банки будут пресными. Из этого мизерного количества большая часть превратится в грунтовые воды, примерно четверть – в лед, а около двух капель станут пресной водой в реках и озерах.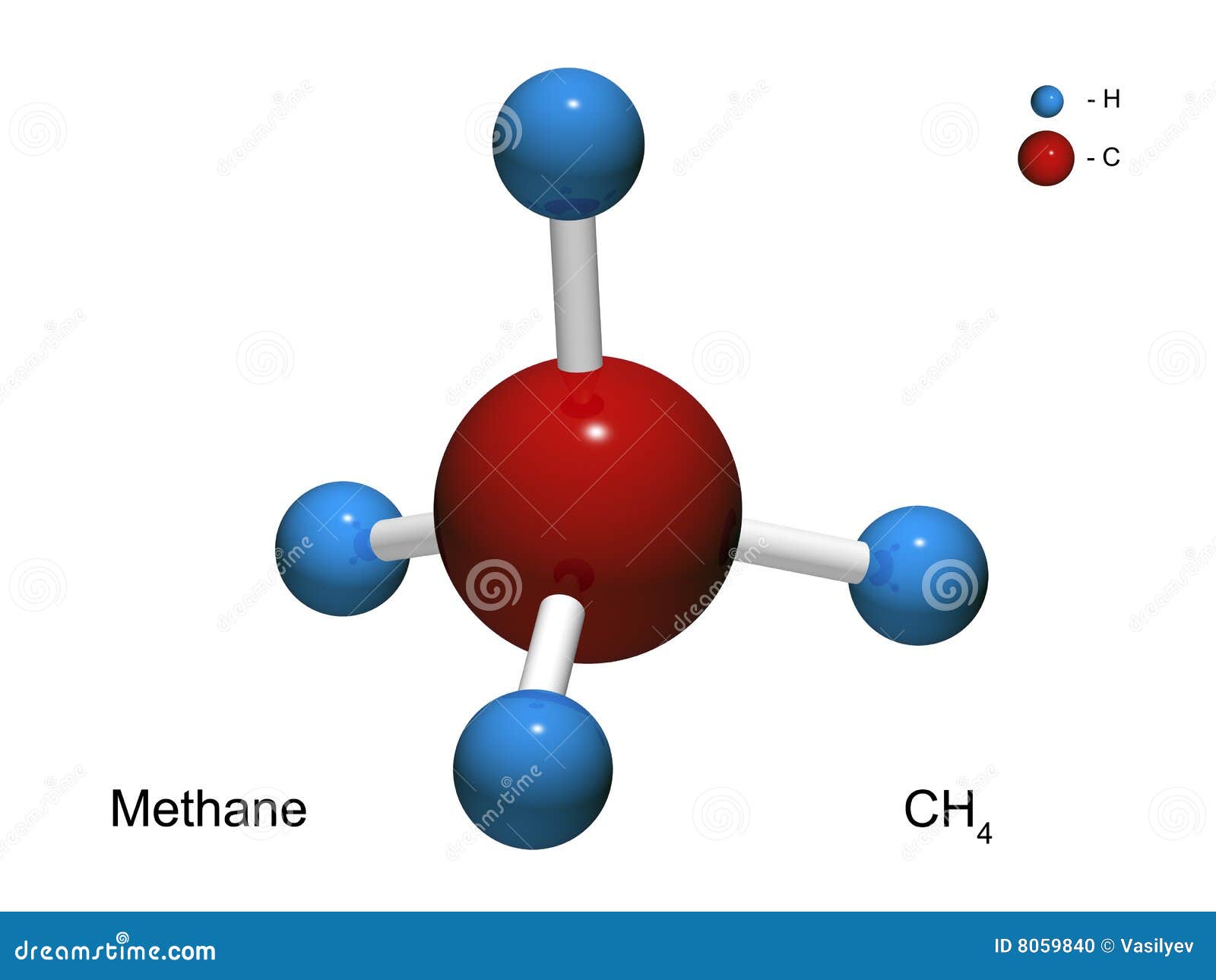 И вот это малое количество пресной воды нужно разделить на 8 млрд человек. Вместе с осознанием данного факта приходит понимание того, насколько важно подойти со всей ответственностью к использованию такого драгоценного ресурса.
И вот это малое количество пресной воды нужно разделить на 8 млрд человек. Вместе с осознанием данного факта приходит понимание того, насколько важно подойти со всей ответственностью к использованию такого драгоценного ресурса.
Во многих развитых странах уже давно воспитывается культура экономии воды. Тем не менее сегодня в среднем каждый человек расходует около 100 литров ежедневно, а в некоторых странах, как, например, США, этот показатель достигает 500 литров. Конечно, речь идет не только о двух литрах воды в день для питья и воды для личной гигиены, большая часть потребления пресной воды приходится на производство продуктов питания. Кроме того, здесь учитываются и расходы на орошение. Сейчас все чаще растения не просто беспечно поливаются водой из шланга, постепенно внедряется система капельного орошения, когда точное количество воды подается для полива каждого саженца по отдельности.
Пока человечество переосмысливает подходы к использованию водных ресурсов, ситуацию с нехваткой чистой пресной воды осложняют и факторы, не зависящие от нас. В их числе и климатические изменения, повышение общей температуры Земли, а также различные природные катаклизмы. Осознавая все риски для источников пресной воды, человечество продолжает активную работу по поиску новых и более совершенных способов производства пресной воды.
В их числе и климатические изменения, повышение общей температуры Земли, а также различные природные катаклизмы. Осознавая все риски для источников пресной воды, человечество продолжает активную работу по поиску новых и более совершенных способов производства пресной воды.
Из соленой в пресную: от Аристотеля до наших дней
Уже сегодня для многих стран опреснение воды стало стратегической государственной программой, например для Израиля или ОАЭ. Ученые постоянно работают над совершенствованием способов, как сделать морскую воду пригодной для потребления.
На первый взгляд, эта задача не кажется сложной – всего лишь удалить 35 граммов соли из литра воды. Именно столько соли содержится в литре морской воды, а для питьевой эта величина не должна превышать одного грамма. Над этим задумывался еще Аристотель, пытаясь изобрести особые фильтры. В своих наблюдениях древнегреческий философ отмечал, что соленая морская вода, проходя через стенки воскового сосуда, опресняется. По сути, это были первые опыты с применением технологии обратного осмоса – этот метод найдет свое применение спустя более 2 тысяч лет, в середине XX века.
По сути, это были первые опыты с применением технологии обратного осмоса – этот метод найдет свое применение спустя более 2 тысяч лет, в середине XX века.
Кроме обратного осмоса, было придумано и множество других способов получить из морской воды опресненную, и даже в домашних условиях. Самый распространенный способ, который сегодня применяется не только путешественниками в экстремальных условиях, но и в промышленном опреснении, – дистилляция.
Опыт по дистилляции воды можно провести и в домашних условиях. Для этого достаточно разместить лист прозрачного пластика на чаше с соленой водой. Если поставить такую конструкцию под солнечные лучи, вода будет медленно испаряться. Образовавшийся в итоге конденсат на нижней стороне пластикового листа – это и есть пресная вода. Промышленные дистилляционные установки повторяют данный процесс в крупном масштабе, работая на электричестве, – дистилляция достаточно энергозатратна.
Сегодня применяется и множество других способов опреснения. Например, ионный обмен. Воду пропускают через фильтры из ионообменных смол – таким образом можно заменить ионы. К примеру, ионы натрия – на ионы водорода, а ионы хлора – на гидроксид-ионы. В итоге вместо NaCl (хлорид натрия, то есть та самая соль в морской воде) получается H2O. Это и есть опреснение. По такому принципу работают некоторые бытовые фильтры водопроводной воды. Недостаток данного метода – в его стоимости. Ионообменные системы – достаточно затратны, поэтому для опреснения морской воды их практически не используют.
На сегодняшний день один из самых современных методов опреснения, который нашел применение и в крупных опреснительных установках, и на обычной кухне, основан на явлении обратного осмоса.
Обратный осмос: как это работает
Перед тем как разобраться, что такое обратный осмос, нужно понять явление обычного осмоса. Прямой осмос – это баромембранный массообменный процесс. Простыми словами его можно описать следующим образом: молекулы растворителя под осмотическим давлением через мембрану переходят на сторону раствора и разбавляют его. Раствор увеличивается, в свою очередь, под ростом гидростатического давления. Процесс прекращается, когда статическое и осмотическое давления приходят в равновесие. Таким образом для этого процесса нужны раствор, растворитель, а также барьер – полупроницаемая мембрана.
Прямой осмос – это баромембранный массообменный процесс. Простыми словами его можно описать следующим образом: молекулы растворителя под осмотическим давлением через мембрану переходят на сторону раствора и разбавляют его. Раствор увеличивается, в свою очередь, под ростом гидростатического давления. Процесс прекращается, когда статическое и осмотическое давления приходят в равновесие. Таким образом для этого процесса нужны раствор, растворитель, а также барьер – полупроницаемая мембрана.
Кстати, именно прямой осмос лежит в основе обменных процессов всех живых организмов на клеточном уровне – так «работают» водно-солевой обмен, получение питательных веществ, вывод продуктов жизнедеятельности. В природе роль полупроницаемой перегородки играет стенка клетки. По иронии именно из-за осмоса и нельзя пить морскую воду. Когда соленая вода попадает в пищеварительный тракт, осмос вытягивает воду из клеток, в итоге наступают обезвоживание и смерть.
Однако процесс осмоса – обратимый. Если солевой раствор будет находиться под высоким давлением, молекулы воды станут проходить через мембрану в обратном направлении – в сторону емкости с чистой водой. Таким образом, полупроницаемая мембрана действует как очень тонкий фильтр: чистая вода проходит, а в контейнере остается меньшее количество более концентрированного солевого раствора.
Если солевой раствор будет находиться под высоким давлением, молекулы воды станут проходить через мембрану в обратном направлении – в сторону емкости с чистой водой. Таким образом, полупроницаемая мембрана действует как очень тонкий фильтр: чистая вода проходит, а в контейнере остается меньшее количество более концентрированного солевого раствора.
Именно такой принцип лежит в основе работы новой установки МО-140-М от холдинга «Швабе». Разработана она для опреснения воды с высокими концентрациями соли (до 59 г/л) и окисляемыми примесями, например нефтепродуктами и взвесями. В ходе очистки также устраняются бактерии, вирусы, запах, привкус, мутность, минимизируется количество железа и марганца.
Так что система на основе обратного осмоса не только поможет получить питьевую воду из морской воды, но и особо чистую воду для медицины, промышленности и других нужд. Обратный осмос считается более экономически выгодной альтернативой промышленной дистилляции, однако стоимость строительства одного такого крупного водоочистительного сооружения может достигать миллионов долларов. Эти установки все еще могут быть непосильны для некоторых регионов, где присутствует дефицит питьевой воды.
Эти установки все еще могут быть непосильны для некоторых регионов, где присутствует дефицит питьевой воды.
В таких случаях на помощь могут прийти более компактные варианты, такие как новая система от «Швабе». К тому же она существенно дешевле существующих аналогов – если брать минимальную рыночную цену на подобное оборудование, экономия составит почти 25%. Эта техника точно будет востребована в Крыму и в других южных регионах России, которые периодически сталкиваются с проблемами обмеления водохранилищ из-за сильной засухи и, как следствие, ограничением водоснабжения.
Разработке пророчат и хороший экспортный потенциал. Функционал установки позволяет применять ее для опреснения воды практически любого моря. Потенциальными экспортными рынками сбыта могут стать Южная Африка, страны Персидского залива – там потребность в подобном оборудовании действительно высока.
Живая и неживая
Мы не знаем точно, откуда берутся мифы о воде. На эту тему существует множество спекуляций, затрагивающих и биологическую роль воды, и ее культурное значение, и даже тот факт, что с точки зрения физики и химии вода действительно представляет собой очень необычную жидкость. Но поскольку «очень необычную» не означает «волшебную и загадочную», мы решили отделить зерна от плевел и вспомнить самые популярные поверья о свойствах воды. А заодно и разобраться, что с ними не так. Этот материал мы подготовили совместно с компанией «Аквафор».
На эту тему существует множество спекуляций, затрагивающих и биологическую роль воды, и ее культурное значение, и даже тот факт, что с точки зрения физики и химии вода действительно представляет собой очень необычную жидкость. Но поскольку «очень необычную» не означает «волшебную и загадочную», мы решили отделить зерна от плевел и вспомнить самые популярные поверья о свойствах воды. А заодно и разобраться, что с ними не так. Этот материал мы подготовили совместно с компанией «Аквафор».
1. Память воды
«Возьмите физику и выбросьте ее в мусорное ведро: у воды есть память! И хотя ее память о крохотной капельке лукового сока кажется бесконечной, обо всем дерьме, что в ней плавало, она почему-то забывает. ..» — Тим Минчин, «Шторм».
..» — Тим Минчин, «Шторм».
Что утверждается?
Вода обладает способностью запоминать, какие вещества в ней были растворены. И не только запоминать, но и воспроизводить свойства растворов, притом что ни одной молекулы нужного вещества в растворе фактически нет. Достигается такой эффект за счет того, что молекулы воды определенным якобы образом выстраиваются вокруг молекул растворенного вещества и впоследствии сохраняют эту структуру.
Откуда это взялось?
Популярный термин «память воды» появился благодаря работам французского иммунолога Жака Бенвениста в конце 1980-х — начале 1990-х годов. В серии экспериментов по активации базофилов (разновидностей лейкоцитов, играющих важную роль в аллергических реакциях организма) команда под руководством Бенвениста показала, что при последовательном уменьшении концентрации антител, активирующих базофилы, наблюдался отклик последних даже в том случае, когда статистически в пробе не могло остаться ни одного антитела. К чести исследователей надо отметить, что они не стали предлагать какого-либо революционного теоретического объяснения новым результатам, а в описании методической части их работы не было каких-либо критических ошибок. Тем не менее, полученные ими результаты противоречили имевшимся на тот момент представлениям о физико-химических свойствах воды. По этой причине редактор журнала Nature, в который Бенвенист и коллеги отправили статью по результатам работы, согласился принять публикацию с тем условием, что исследователи проведут повторный эксперимент под наблюдением специальной комиссии.
Тем не менее, полученные ими результаты противоречили имевшимся на тот момент представлениям о физико-химических свойствах воды. По этой причине редактор журнала Nature, в который Бенвенист и коллеги отправили статью по результатам работы, согласился принять публикацию с тем условием, что исследователи проведут повторный эксперимент под наблюдением специальной комиссии.
Статья была опубликована в Nature в июне 1988 года. Вскоре после этого ученые попытались воспроизвести свои результаты под наблюдением комиссии (в которую даже входил профессиональный иллюзионист). Вначале им это удалось, однако при попытке сделать то же самое в слепом тесте (когда экспериментатор не знал, в какой пробирке действующее вещество, а в какой — пустой образец или стандарт для сравнения) все изменилось: вода отказалась что-либо запоминать. До сих пор неизвестно, чем был обусловлен изначальный успех Бенвениста. То ли он сознательно хотел обмануть научное сообщество, то ли искренне поверил в свои невероятные результаты, но ученый так и не признал собственной ошибки, закончил академическую карьеру и продолжил эксперименты в независимой лаборатории.
Как все обстоит на самом деле?
Представление о «памяти воды» противоречит современным концепциям физической химии. Несмотря на то, что вода действительно имеет структуру, эта структура постоянно меняется, тогда как понятие «памяти» предполагает наличие определенного состояния в течение продолжительного времени. По крайней мере, до того момента, когда потребуется «считать» информацию, «записанную» ранее. Экспериментально показано, что характерное время жизни структур, образованных молекулами жидкой воды, измеряется пикосекундами, то есть интервалом порядка 10-12 секунды. Этот период определяется временем жизни водородных связей между соседними молекулами воды. Даже без дополнительных оценок понятно, что за время, которое требуется для манипуляции с пробирками, вода успеет многократно поменять свое состояние, «забыв» все, что ей пытались «сообщить» ранее.
Память воды очень часто напрямую соотносят с гомеопатией, что не совсем корректно. Действительно, памятью воды можно было бы объяснить механизм действия гомеопатических разведений, однако она не является основополагающим принципом. Создатель гомеопатии Христиан Ганеман объяснял ее действие принципом «подобное лечится подобным», когда препарат, вызывающий определенные симптомы, в предельно малых разведения якобы воздействует обратным образом, то есть эти самые симптомы исцеляет. Кроме того, гомеопатические препараты часто существуют не в виде водных растворов, а в виде сахарных шариков, поэтому одной памятью воды их действие не объяснить, нужна еще «память сахара».
2. Зарядка воды на расстоянии
«Я попрошу вас приготовить кремы: самые простые, самые нейтральные, с тем, чтобы я в процессе сеанса их зарядил», — Аллан Чумак, телесеанс от заболеваний опорно-двигательного аппарата.
Что утверждается?
Воду можно «зарядить» при помощи определенного сигнала, обычно электромагнитного, отчего она приобретет свойства раствора какого-то специфичного вещества. Сигнал, несущий информацию, можно оцифровать и передать на расстояние при помощи любого средства связи. Таким образом, с помощью особых манипуляций, имея в наличии только чистую воду и нужный сигнал, можно воспроизвести свойства определенного раствора, например лекарства. В некоторых случаях считается, что вода запоминает информацию вообще, например эмоции, хорошие или плохие слова.
Откуда это взялось?
В академической сфере о зарядке воды на расстоянии впервые заговорил тот же Жак Бенвенист — это был следующий шаг его группы после предполагаемого открытия памяти воды. Однако после провала эксперимента под контролем комиссии Бенвенист потерял авторитет в академических кругах, поэтому все последующие проведенные им эксперименты практически не получили внимания со стороны его коллег.
Другим классическим примером работ в этой области являются произведения японского автора Масару Эмото, который прославился своими заявлениями о том, что вода способна впитывать информацию, причем для этого даже не обязательно ее облучать. Достаточно поместить бумажку с определенным словом на крышку емкости с водой, чтобы эмоция или информация, соответствующая этому слову, записалась в структуру воды. В доказательство своей гипотезы Эмото приводил внешний вид микрокристаллов воды, «заряженной» различной информацией. Как и стоило ожидать, «положительные» эмоции, как и классическая музыка, например, придают кристаллам воды (согласно результатам Эмото) правильную, красивую форму. При этом отрицательные эмоции или музыка в жанрах рок или метал приводят к образованию некрасивых, деформированных кристаллов.
Опыты Бенвениста и Эмото в России не получили такой широкой огласки, как работы другого специалиста по зарядке воды на расстоянии — Аллана Владимировича Чумака. В ходе своих телесеансов целитель заряжал воду (и не только) при помощи пассов руками, хотя вода и не считалась основным объектом воздействия: исцеляться можно было и без нее, просто сидя у телевизора. В отличие от Бенвениста, использующего научную методологию для подтверждения наличия памяти у воды, Чумак объяснял свой талант даром свыше и не апеллировал к французскому ученому, хотя и работал с ним примерно в одно время. Именно потому, что Чумак не использовал псевдонаучных концепций, его действия не привлекли пристального внимания научных комиссий, за исключением упоминания в ряду других телевизионных экстрасенсов — Анатолия Кашпировского и Юрия Лонго.
Как все обстоит на самом деле?
Никто из создателей и адептов этого мифа даже не пытался придумать механизм, в соответствии с которым электромагнитное излучение могло бы записывать информацию прямо в воду. Так, Масару Эмото, несмотря на популяризацию собственных экспериментальных данных, никогда не приводил подробной методологии эксперимента, а также не имел рецензированных публикаций, за что не раз подвергался критике со стороны научного сообщества. Поэтому, кроме теории о памяти воды, о которой говорилось выше, обсуждать здесь нечего. От себя добавим, что с точки зрения физической химии не стоит ожидать прямого соответствия между структурой воды и льда. Действительно, при плавлении льда в воде обнаруживаются крупные кластеры, обладающие схожей со льдом структурой, однако при нагревании хотя бы до комнатной температуры эта структура полностью теряется и вода становится аморфной.
Можно ли зарядить воду (если принять гипотезу о существовании ее памяти) при помощи обычного бытового телевизора? Поскольку мы не знаем точного механизма передачи информации воде, можно только предположить, как должен происходить подобный эксперимент. Раз заряженная вода должна определенным образом воздействовать на клеточные процессы, характерный размер кластеров, несущих информацию, должен быть сопоставим с типичными биологическими макромолекулами, то есть не превышать десятков нанометров. Телевизор в основном излучает электромагнитные волны видимого спектра, длина волны которых составляет от 400 до 760 нанометров. Тем не менее, можно вспомнить, что телевизоры во времена трансляций Чумака были кинескопическими, то есть основным их рабочим элементом была электронно-лучевая трубка. В ней формировался пучок электронов, который попадал на флуоресцентный экран. Известно, что в подобных приборах создается вторичное рентгеновское излучение, которое характеризуется длиной волны от 10 нанометров и меньше. К счастью, большая часть рентгеновского излучения кинескопа поглощается специальным металлизированным стеклом. Остаточное же излучение обладает настолько малой интенсивностью, что будет быстро поглощено материалом емкости, в которой вода стоит перед телевизором. Поэтому даже в случае существования памяти воды ее зарядка посредством телевизора выглядит маловероятной.
3. Структурированная вода
— А океаны, в которые впадают замерзшие реки? <…> А ключи, которые питают замерзшие реки и озера, а все подземные источники, питающие эти ключи…
— Замерзнут, черт побери! <…>
— А дождь?
— Коснулся бы земли и превратился в твердые катышки, в лед-девять, и настал бы конец света.
(Курт Воннегут, «Колыбель для кошки»)
Что утверждается?
Не только память воды как способность воспроизводить определенную информацию, но и структура воды сама по себе играет огромную роль в биологических процессах в организме. Так, вокруг здоровых клеток вода структурируется особым образом, а вблизи больных клеток эта структура теряется. В том случае, если человек пьет структурированную воду (талую воду, свежевыжатые соки, фрукты и овощи, воду из специальных приборов — структуризаторов), организм может сразу же использовать ее в своей работе. Если же вода была неструктурированная (водопроводная, кипяченая, дистиллированная), организм затрачивает значительные усилия на ее структуризацию, что приводит к плохому самочувствию. При этом некоторые способы получения структурированной воды опираются на «естественные» подходы. Так, часто можно встретить рекомендацию готовить талую воду на натуральном зимнем морозе, а не в морозильной камере холодильника. У структурированной воды, по словам ее адептов, существует еще целый ряд более специфических эффектов, но мы в них углубляться не будем.
Откуда это взялось?
Точный момент возникновения этой идеи назвать сложно, но можно вспомнить несколько ее предвестников. Один из них — концепция «поливоды», о которой заговорили в СССР в начале 1960-х годов, но которую опровергли к середине 1970-х. В результате пропускания чистой воды через тонкие кварцевые капилляры наблюдалось образование все такой же чистой (предположительно) воды, которая, однако, обладала кардинально новыми свойствами. Так, «поливода» была плотнее, кипела при повышенной, а замерзала — при пониженной температуре, а также обладала колоссальной (по сравнению с обычной водой) вязкостью. Название «поливода» было предложено вслед гипотезе об образовании полимерных цепочек, в которых молекулы воды выступали в качестве мономеров. Существовала даже гипотеза, что поливода может полимеризовать обычную воду при контакте с ней. Эта идея, в частности, обыгрывается в произведении Курта Воннегута «Колыбель для кошки». Когда феноменом поливоды заинтересовались по всему миру, а главное — многим лабораториям удалось воспроизвести результаты советских первооткрывателей, встал вопрос о теоретическом обосновании поливоды. В последующие годы было создано несколько соответствующих теорий, однако при более пристальном контроле эксперимента выяснилось, что все необычные свойства поливоды объяснялись наличием в ней примесей. В отличие от того же Бенвениста, авторы первых работ о поливоде признали собственные ошибки, и о явлении забыли, по крайней мере, в научных кругах.
Как все обстоит на самом деле?
В отличие от идей о памяти воды, понятие «водный кластер» не является лженаучным и широко изучается в физической химии. Речь может идти как о малых кластерах, в которые входят от двух до восьми молекул воды, так и более крупных кластерах, включающих несколько сотен молекул. Характерные размеры таких объектов могут достигать нескольких нанометров. Исследование подобных структур играет важную роль в определении роли воды как растворителя во многих химических и биологических процессах. Однако эта тематика не затрагивает существование долгоживущих кластеров, которые были бы способны нести какую-либо информацию на макроскопических временных масштабах. Характерное время жизни кластера все равно не слишком превышает время жизни водородных связей и лежит в пределах нескольких пикосекунд (при комнатной температуре).
В доказательство особых свойств структурированной воды часто приводят опыты по кристаллизации воды из разных источников. Так, водопроводная или дистиллированная вода в этих экспериментах обычно образует «некрасивые» и несимметричные кристаллы, а структурированная вода — красивые и симметричные. Отсутствие детальной методологии этих экспериментов, а также публикаций в рецензируемых научных журналах позволяет лишь предположить, что эти данные не являются воспроизводимыми. Достаточно заметить, что в реальности все обстоит ровно наоборот: чем более химически чиста вода, тем правильнее и «красивее» будут ее кристаллы, так что дистиллят должен занимать чуть ли не первое место в подобном «конкурсе красоты».
4. Кислородная, электролизованная и бездейтериевая вода
«В процессе применения новой специальной технологии расстояние между молекулами воды увеличивается, и это свободное пространство занимают дополнительные молекулы кислорода. Таким образом, обеспечивается длительная устойчивая связь воды и кислорода», — неизвестный автор о кислородной воде.
Что утверждается?
Существуют сравнительно простые способы придания обычной питьевой воде уникальных оздоравливающих свойств. К этим способам относится насыщение кислородом, чтобы он попадал в кровь через желудочно-кишечный тракт, электролизация воды с целью образования щелочной воды, кислотной воды и атомарного водорода, которые служат антиоксидантами и способствуют оздоровлению организма, а также удаление из воды примеси более тяжелого изотопа водорода — дейтерия, которого в норме в воде содержится около 0,01 процента. Бездейтериевая, или «легкая», вода также способствует общему оздоровлению организма и оказывает терапевтический эффект при раковых заболеваниях.
Откуда это взялось?
Все эти утверждения основаны на желании найти что-то необычное в обычной воде, то есть производить различные манипуляции с составными частями самой воды. Отследить точный момент появления подобных идей оказалось непросто. Так, кислородные коктейли появились в советской медицине еще в 1960-х годах, но, в отличие от собственно кислородной воды, в коктейле кислород удерживается в плотной пенной шапке, способной доставить значительный объем кислорода в желудочно-кишечный тракт. Бездейтериевая вода, с точки зрения биологических применений, впервые упоминается в начале 1990-х годов. Примерно в то же время в Японии набрала популярность электролизованная или ионизированная вода.
Как все обстоит на самом деле?
Из трех перечисленных типов воды проще всего разобраться, вероятно, с кислородной водой. Дело в том, что, в отличие от углекислого газа, кислород растворяется в воде не так хорошо: достаточно для рыб, но недостаточно, чтобы оказать реальное влияние на газообмен человека, поэтому сама по себе идея кислородной воды выглядит слабореализуемой с точки зрения физической химии. Именно поэтому при максимальном насыщении воды кислородом то количество газа, которое один литр воды принесет в кишечник (даже если считать его всасываемость 100-процентной), будет сопоставимо с содержанием кислорода в одном вдохе взрослого человека. Таким образом, даже самые простые оценки опровергают заявления о значительном тонизирующем эффекте от употребления кислородной воды. Все утверждения о существовании «особых технологий», позволяющих каким-то иным способом перенасытить воду кислородом при комнатной температуре и в отсутствие дополнительных химических примесей, также не выдерживают простейшей критики со стороны базовой термодинамики.
С электролизованной и бездейтериевой водой все оказывается чуть сложнее, так как в обоих случаях имеются опубликованные исследования, в которых так или иначе демонстрируется положительный эффект этих препаратов. Например, употребление бездейтериевой воды замедляло (PDF) гибель популяции мышей, пораженных раковыми опухолями. Однако исследования, посвященные бездейтериевой и электролизованной воде, оказались очень локализованными (электролизованная вода исследуется и употребляется преимущественно в Азии) и широкого распространения в научном сообществе не получили. Их принципы остаются не до конца понятыми, а зачастую и противоречивыми. В случае с электролизованной водой, например, остается непонятым вопрос о том, чем «кислотная» и «щелочная» вода отличается от раствора кислоты и щелочи соответственно.
5. Серебряная вода
«Жуткий город: девок нет, в карты никто не играет. Вчера в трактире украл серебряную ложку — никто даже не заметил: посчитали, что ее вообще не было», — из кинофильма «Формула любви».
Что утверждается?
Вода, настоянная в серебряной посуде или на серебряном предмете (рубле, ложке), долго не портится, обладает сильным бактерицидным эффектом и полезна для внутреннего употребления. Частный случай — святая вода обладает целебными эффектом благодаря тому, что во время обряда освящения используется серебряная утварь.
Откуда это взялось?
О целебных свойствах серебра говорится очень давно: первые упоминания можно найти у Геродота и в последующих римских источниках. В основном речь ведется о настаивании воды в серебряной посуде, что якобы увеличивает срок ее хранения. Долгое время серебро в различных формах использовалось для обеззараживания воды и обработки ран, однако с появлением более эффективных антисептиков серебро отошло на второй план. В современной практике серебро в виде растворов его солей или коллоидных частиц можно использовать, например, для «мягкого» обеззараживания воды, например, в некоторых фильтрах для питьевой воды.
Как дело обстоит на самом деле?
Данный миф — миф лишь отчасти. Действительно, серебро в ионной форме, как и многие другие тяжелые металлы, например, медь, обладает бактериостатическим и (в высоких концентрациях) бактерицидным эффектом. Это означает, что лишь в сравнительно высоких концентрациях растворы солей серебра способны эффективно убивать бактерии, но чаще они лишь замедляют рост микроорганизмов. Всемирная организация здравоохранения в 2014 году опубликовала большой отчет (PDF) о перспективах применения серебра в качестве дезинфицирующего агента. Вкратце выводы этой работы сводятся к тому, что, несмотря на большой объем современных исследований ионов серебра и его коллоидных растворов, далеко не во всех случаях приведенных данных достаточно для того, чтобы сделать окончательный вывод об эффективности таких препаратов для применения в водоподготовке. В то же время серебро, как и другие тяжелые металлы, накапливается в организме и им вполне можно отравиться (это заболевание называется аргироз), поэтому существует норма предельно допустимой концентрации (ПДК) серебра, превышение которой в питьевой воде ничего хорошего не сулит.
Другой проблемой серебряной воды является тот факт, что серебряная ложка или рубль, опущенные в воду, дают пренебрежимо малый вклад в содержание серебра в ионной форме. Именно поэтому настаивание воды на серебряных предметах обладает довольно слабой эффективностью с точки зрения дезинфекции. По этой же причине касание воды серебряным крестом во время освящения не придает воде никаких особых свойств, за исключением символической ценности, обусловленной ее ролью во многих религиозных обрядах. Важно помнить, что освящение воды не изменяет ее физико-химических свойств, а главное — не очищает ее. Из-за этого происходят и курьезные случаи: анализ выборки святых источников и церемониальных сосудов для воды в Австрии показал, что в 86 процентах случаев исследуемая вода не пригодна для питья из-за присутствия в ней вредоносных микроорганизмов. Возвращаясь к серебру: если все-таки есть потребность насытить воду его ионами, то для этого можно добавить растворимую соль серебра (нитрат, например), или воспользоваться специальным прибором — ионизатором. Его применение действительно позволяет добиться бактерицидного эффекта, однако с его помощью очень легко превысить ПДК серебра в питьевой воде. В этом случае регулярное употребление ионизированной серебряной воды может привести к серьезным последствиям для здоровья.
Как упоминалось выше, этот материал мы подготовили совместно с компанией «Аквафор». Поэтому наш разбор мифов о воде мы завершим простым, но важным напоминанием: пить надо воду, очищенную современными фильтрами, созданными на основе научных данных, а не лженаучных мифов. Такими, как, например, фильтры «Аквафор» — обычный кувшин, система очистки воды с защитой от бактерий и система очистки воды премиум класса с дополнительной минерализацией.
Тарас Молотилин
Электричество из лужи, или Как получить энергию из воды — Энергетика и промышленность России — № 19 (327) октябрь 2017 года — WWW.EPRUSSIA.RU
Газета «Энергетика и промышленность России» | № 19 (327) октябрь 2017 года
Без еды человек может прожить от четырех до шести недель, а вот без воды – не более трех дней. Впрочем, не только человек, все живое нуждается в воде.Однако именно человек пошел дальше всех, ведь людям вода нужна не только для поддержания жизни, приготовления пищи и гигиены, но и для многого другого. Воду мы используем и в быту, и на производстве. И вот теперь человечество всерьез задумалось о том, чтобы добывать из воды энергию!
Конечно, человек давно уже умеет добывать энергию с помощью воды, для чего служит огромное количество гидроэлектростанций, построенных по всему миру. Однако можно ли добывать энергию прямо из воды?
Невозможное возможно?
В принципе, современная физика к подобному относится с изрядным скепсисом. Ведь, в соответствии с фундаментальными физическими законами, нет способа извлекать химическую энергию из воды. У воды отрицательная энтальпия образования, следовательно, для разделения ее на элементы требуется затратить энергию. Не существует соединений кислорода и водорода с большей негативной энтальпией образования, за счет которой мог бы быть получен избыток энергии. Поэтому многие изобретатели, которые заявляли, что научились добывать энергию непосредственно из воды, получали клеймо мошенников.Однако изобретателей это не останавливает, и раз за разом ученые пытаются добиться невозможного. Вот и опять не так давно была опубликована информация о том, что ученые разработали технологию, благодаря которой из воды стало возможно получать экологически чистую энергию. Якобы этого добился профессор Массачусетского технологического института Дэниэл Носер.
Прототип получил название Sun Catalytix. Для извлечения водорода из воды устройство использует солнечную энергию. Специальный солнечный элемент помещается в сосуд с водой. При попадании на него света образуются пузырьки водорода. Процесс получения дешевой энергии из воды полностью обратим. При помощи солнечного света происходит разложение воды на водород и кислород. Получаемый кислород впоследствии используется при горении водорода. Конечным продуктом горения снова является вода. Получается такой себе «круговорот воды в природе» в пределах энергетической установки. По сути, солнечная энергия преобразуется в удобную для использования форму посредством воды.
Разработчики уверены, что их изобретение сможет применяться не только для обеспечения энергией отдельных домов и учреждений, но даже в транспортных средствах. Их уверенность была подкреплена грантом в размере 4 млн долл. от Агентства исследований в области энергетики и индийского машиностроительного гиганта Tata. Была даже создана «Sun Catalytix Corporation».
По словам разработчиков, их технология обеспечит источниками бесплатной энергии как жилые дома, так и другие объекты в странах третьего мира. Сюда включаются и транспортные решения, и промышленные предприятия и т. д.
Единственное, что смущает в этой «новости» – датирована она 2011 г., а Google даже утверждает, что «по их данным, компания Sun Catalytix Corporation закрыта навсегда».
Топливо из воды
Так что же получается? Неужели физика права, и вода не сможет нам помочь в деле производства энергии? Возможно, это и так, но из воды можно получить топливо. Например, водород. Сейчас водород получают, главным образом, из природного газа методом каталитической конверсии с водяным паром. Пока это самый дешевый способ, но в конечном итоге такой путь ведет в тупик, ведь запасы газа рано или поздно тоже закончатся. Неиссякаемым источником водорода может служить вода. Электролиз воды технически осуществить довольно просто, но этот процесс требует значительных энергозатрат. Технология будет экономически выгодной только в том случае, если использовать дешевую электроэнергию, получаемую желательно из возобновляемых источников, – за счет энергии воды, ветра, солнца.Еще в 1935 г. Чарльз Гаррет продемонстрировал «в течение нескольких минут» работу «водяного автомобиля». Как можно увидеть из патента Гаррета, оформленного в том же году, для генерации водорода применялся электролиз. Повторить успех Гаррета пытались и другие изобретатели. Конечно, в этом деле тоже не все так просто. И многие изобретатели, заявлявшие, что добились в вопросе получения топлива из воды существенного прогресса, также оказались мошенниками.
Например, в 2002 г. Genesis World Energy анонсировала готовое к продвижению на рынок устройство, которое извлекало бы энергию из воды путем ее разложения на водород и кислород. Увы, в 2006 г. Патрик Келли, собственник GWE, был приговорен в Нью-Джерси к пяти годам тюрьмы за кражу и выплате возмещений в размере 400 тыс. долл.
Другой изобретатель, Дэниэл Дингел, заявлял, что разработал технологию, позволяющую использовать воду в качестве топлива. В 2000 г. Дингел стал бизнес-партнером компании Formosa Plastics Group с целью дальнейшего развития технологии. Но в 2008-м компания подала на изобретателя иск за мошенничество, и 82‑летний Дингел был приговорен к 20 годам тюрьмы.
В том же 2008 г. СМИ Шри-Ланки сообщили о некоем гражданине этой страны по имени Тушара Приямал Эдиризинге, который утверждал, что проехал около 300 км на «водяном автомобиле», потратив 3 литра воды. Тушара продемонстрировал свою технологию премьер-министру Ратнасири Викреманаяке, который пообещал всемерную правительственную поддержку его усилий по продвижению водяного автомобиля на рынок Шри-Ланки. Однако несколько месяцев спустя Тушара был арестован по обвинению в мошенничестве.
Шанс все же есть
Вместе с тем, ошибочно думать, что все, кто занимается проблемой получения топлива из воды, – мошенники. Например, авторитетный ученый Джеффри Хьюитт даже стал лауреатом премии «Глобальная энергия» в 2007 г. за идею производства топлива на основе энергии воды. К сожалению, сам ученый считает, что подобные методы добычи топлива еще долго останутся недоступными для будничного использования в связи с их высокой стоимостью. По его мнению, стоимость такой энергии безумно велика, и время, когда экологичные виды топлива можно будет использовать в повседневной жизни, настанет еще не скоро. Так что пока энергия из воды – не конкурент традиционной энергетики. Однако ученый уверен, что эту отрасль энергетики необходимо активно развивать, так как применение, например, водородного сырья может повысить коэффициент полезного действия электростанций до 85 % с текущего уровня в 50 %. И в будущем новое горючее способно заменить все существующие ныне ресурсы.Так что ученые не зря бьются над этой проблемой. Возможно, в скором времени это принесет свои плоды. Например, в марте этого года пришло сообщение, что в процессе лабораторных исследований ученые из Калифорнийского университета научились создавать топливо из воды. Над созданием альтернативного вида топлива американские специалисты начали работу еще два года назад. На протяжении этого времени ученые обнаружили, что при правильном расщеплении молекул воды получается горючее, которое в будущем способно заменить все существующие ныне ресурсы. Полученный результат не до конца удовлетворил ученых, поэтому исследовательская работа еще продолжается.
Новый метод, который разработали специалисты, способен расщеплять воду на несколько молекул. При правильном синтезе водорода возникают процессы, которые присущи топливу. Однако существует основная проблема, решением которой занимаются ученые. Дело в том, что расщепленные молекулы подвергаются стремительному разрушению, в результате чего синтезировать все элементы не представляется возможным.
На сегодняшний день ученые работают над созданием метода, который бы позволил использовать все полученные элементы. Конечно, это вновь может оказаться уткой, но возможно что и нет. И если результаты научной работы окажутся положительными, то человечество получит новый альтернативный вид топлива, ресурсы которого будут неограниченными.
% PDF-1.4 % 312 0 объект > эндобдж xref 312 101 0000000017 00000 н. 0000002493 00000 н. 0000003725 00000 н. 0000004450 00000 н. 0000004477 00000 н. 0000004615 00000 н. 0000004755 00000 н. 0000004836 00000 н. 0000004862 00000 н. 0000005233 00000 п. 0000005399 00000 н. 0000005514 00000 н. 0000005609 00000 н. 0000005705 00000 н. 0000005841 00000 н. 0000198272 00000 н. 0000283847 00000 н. 0000284361 00000 п. 0000284749 00000 н. 0000288473 00000 н. 0000288592 00000 н. 0000288975 00000 н. 0000289270 00000 н. 0000306785 00000 н. 0000307174 00000 н. 0000307281 00000 н. 0000307710 00000 н. 0000307999 00000 н. 0000329806 00000 н. 0000330219 00000 п. 0000330384 00000 н. 0000330499 00000 н. 0000330602 00000 н. 0000330767 00000 н. 0000330969 00000 н. 0000331066 00000 п. 0000331190 00000 н. 0000331314 00000 н. 0000331438 00000 н. 0000331583 00000 н. 0000331748 00000 н. 0000331929 00000 н. 0000332053 00000 н. 0000332222 00000 н. 0000332403 00000 н. 0000332520 00000 н. 0000332657 00000 н. 0000332800 00000 н. 0000332965 00000 н. 0000333124 00000 н. 0000333248 00000 н. 0000333393 00000 н. 0000333558 00000 н. 0000333737 00000 н. 0000333860 00000 н. 0000334004 00000 н. 0000334141 00000 п. 0000334306 00000 н. 0000334485 00000 н. 0000334622 00000 н. 0000334745 00000 н. 0000334868 00000 н. 0000335033 00000 н. 0000335213 00000 н. 0000335336 00000 н. 0000335473 00000 н. 0000335638 00000 н. 0000335818 00000 н. 0000335983 00000 п. 0000336140 00000 п. 0000336263 00000 н. 0000336407 00000 н. 0000336572 00000 н. 0000336729 00000 н. 0000336894 00000 н. 0000337029 00000 н. 0000337174 00000 н. 0000337318 00000 н. 0000337483 00000 н. 0000337661 00000 н. 0000337780 00000 н. 0000337903 00000 н. 0000338047 00000 н. 0000338186 00000 н. 0000338351 00000 п. 0000338500 00000 н. 0000338619 00000 н. 0000338784 00000 н. 0000338933 00000 н. 0000339056 00000 н. ou # O3% üg «W̩5a8Qz) m% -iIK ڤ R
D = L4E
| |
Возвращаясь к основам химии: Как простое мыло спасает жизни | Университет Эмори
Ученые спешат найти эффективные методы лечения и вакцины от инфекции COVID-19, охватывающей весь мир.Между тем, социальное дистанцирование и гигиена — лучшая защита.
Химик из Университета Эмори Билл Вуэст, занимающийся исследованиями дезинфицирующих средств, недавно появился на The Weather Channel, чтобы объяснить, как мытье рук с простым мылом и водой может уничтожить коронавирус, вызывающий инфекции, чтобы минимизировать его распространение.
«Об этой пандемии так много неизвестного, что вызывает страх и приводит к иррациональным действиям, таким как паническая покупка туалетной бумаги», — говорит Вуэст.«Важно сосредоточиться на том, что мы действительно знаем — мытье рук правильно и часто с мылом и водой может помочь снизить ваши шансы заразиться многими патогенами и передать их другим».
Мыло и вода действуют благодаря гидрофобному эффекту — базовой химической концепции, объясняющей, почему масло и вода не смешиваются. Эффект управляет сворачиванием белков — процессом, который изменяет структуру аминокислот и позволяет им выполнять различные функции в клетке.
«Я обычно использую пример сворачивания белка, чтобы рассказать студентам-химикам о гидрофобном эффекте», — говорит Вуэст.«Но теперь я понимаю, что мыло является гораздо более ярким примером».
Молекулы мыла имеют гидрофильные головки, то есть они цепляются за молекулы воды, и хвосты, которые являются гидрофобными, что означает «водобоязнь». При погружении в воду молекулы мыла образуют крошечные шарики, называемые мицеллами, с их гидрофобными хвостами, направленными внутрь. Хотя хвосты молекул мыла хотят избегать попадания воды, их привлекают масла и жиры.
Многие бактерии и вирусы, включая коронавирусы, заключены в оболочку из жирных кислот.Проще говоря, хвосты молекул мыла проникают в эти двухслойные мембраны, разрушая их и уничтожая патогены.
Более высокие температуры усиливают гидрофобный эффект и могут помочь мылу для рук вспениться и удалить грязь или микробы, приставшие к коже, так же как горячая вода и мыло помогают удалить жир с кухонной посуды. Вюст рекомендует намылить руки теплой на ощупь водой. По его словам, данные свидетельствуют о том, что лучше потратить не менее 20 секунд на мытье рук, чтобы удалить больше микробов.
Wuest планирует использовать этот пример с водой и мылом в своем классе Chem 202. Учебная программа Emory’s Chemistry Unbound предназначена для того, чтобы дать студентам контекст для реальных проблем и решений. Хотя мытье водой с мылом может показаться слишком простой темой для студентов колледжа, Уэст теперь понимает, что это не так.
«Эта пандемия изменила мое отношение к обучению», — говорит он. «Даже сейчас я не думаю, что большинство людей тратят полные 20 секунд на мытье рук, но, возможно, если бы они поняли химический состав мыла и воды, это заставило бы их больше осознавать необходимость этого.”
Мытье рук важно для снижения заболеваемости и смертности от многих болезней, включая сезонный грипп, отмечает он.
Если мыло и вода недоступны, дезинфицирующее средство для рук, содержащее не менее 60% спирта, также эффективно разрушает мембраны, окружающие коронавирусы и бактерии. По словам Вуэста, его следует тщательно втирать в руки, пока вся жидкость не испарится.
Вуэст является выдающимся исследователем исследовательского альянса Джорджии и доцентом химического факультета Эмори.Он также является членом Центра устойчивости к антибиотикам Эмори.
Для повседневного использования в немедицинских условиях Вуэст призывает людей выбирать мыло и дезинфицирующие средства для рук, не содержащие антибактериальных ингредиентов. Он подчеркивает, что правильное использование обычного мыла и воды или дезинфицирующих средств на спиртовой основе является ключевым моментом.
«Я беспокоюсь, что через несколько лет может произойти всплеск антибактериальной устойчивости, если слишком много людей начнут использовать антибактериальные продукты для мытья рук», — говорит он.
Если бы вы могли видеть молекулы воды и то, как они действуют, вы бы заметили, что каждая молекула воды электрически притягивает своих соседей. Каждый имеет два атома водорода и один атом кислорода, h30. Необычайная липкость воды обусловлена двумя атомами водорода, которые расположены на одной стороне молекулы и притягиваются к атомам кислорода других близлежащих молекул воды в состоянии, известном как «водородная связь».«(Если бы молекулы жидкости не притягивались друг к другу, то постоянное тепловое перемешивание молекул привело бы к тому, что жидкость мгновенно закипела или испарилась. Атомы водорода имеют одиночные электроны, которые, как правило, проводят много времени «внутри» молекулы воды по направлению к атому кислорода, оставляя свои внешние поверхности обнаженными или заряженными положительно. У атома кислорода восемь электронов, и часто большинство из них находится сбоку от атомов водорода, что делает эту сторону атома отрицательно заряженной.Поскольку противоположные заряды притягиваются, неудивительно, что атомы водорода одной молекулы воды любят указывать на атомы кислорода других молекул. Конечно, в жидком состоянии молекулы имеют слишком много энергии, чтобы зафиксироваться в фиксированном состоянии; тем не менее, многочисленные временные «водородные связи» между молекулами делают воду чрезвычайно липкой жидкостью. Внутри воды, по крайней мере в нескольких молекулах от поверхности, каждая молекула вовлечена в перетягивание каната со своими соседями со всех сторон.Для каждого тяги «вверх» существует тяга «вниз», а для каждого «левого» тяги — «правое» движение, и так далее, так что любая данная молекула вообще не ощущает результирующей силы. На первый взгляд все иначе. Для каждого опускания нет тяги вверх, поскольку, конечно, над поверхностью нет жидкости; таким образом, поверхностные молекулы стремятся втягиваться обратно в жидкость. Чтобы поднять молекулу на поверхность, нужно потрудиться. Если поверхность растягивается — например, когда вы надуваете пузырь — она становится больше по площади, и большее количество молекул вытягивается из жидкости, чтобы стать частью этой увеличенной площади.Этот эффект «растягивающейся кожи» называется поверхностным натяжением.
Поверхностное натяжение играет важную роль в поведении жидкостей. Если вы наполните стакан водой, вы сможете добавить воду над краем стакана из-за поверхностного натяжения.
|
Это всего лишь фаза: моделирование фаз воды
Предпосылки
Вода является неотъемлемой частью земной системы.Вода особенная не только потому, что покрывает более 70% поверхности Земли, но и потому, что это единственное известное вещество, которое может существовать в газообразной, жидкой и твердой фазах в относительно узком диапазоне температур и давлений, существующих на Земле.
Особые качества воды обусловлены уникальной формой молекулы воды. Каждая молекула содержит два атома водорода и один атом кислорода, расположенные так, что одна сторона молекулы (ближайшая к атомам водорода) заряжена положительно, а другая сторона (ближайшая к кислороду) заряжена отрицательно.Если две молекулы воды соединяются, положительная сторона одной притягивается к отрицательной стороне другой, заставляя молекулы цепляться вместе. Этот простой факт объясняет высокую теплоемкость, поверхностное натяжение, когезию, адгезию и другие характеристики, которые делают воду столь важной для биосферы Земли.
В общем, при рассмотрении состояний материи твердые тела более плотные, чем жидкости, а жидкости более плотные, чем газы. Вода в этом отношении немного противоположна.Кроме того, фазы вещества (воды) зависят от температуры или тепловой энергии. Добавление или удаление тепловой энергии увеличивает или уменьшает кинетическую энергию частиц (в данном случае частиц воды). Добавленное тепло или тепловая энергия приводит к разрыву молекулярных связей, что приводит к изменению состояния твердого тела на жидкость, а затем, в конечном итоге, на газ. Твердые тела плавятся, когда они поглощают достаточно тепловой энергии. Напротив, когда жидкость охлаждается, тепловая энергия высвобождается и возвращается в твердую форму.На молекулярном уровне, когда частицы находятся в твердой форме (жидкая вода), частицы обладают меньшей энергией / движением, но частицы обладают большей энергией и более распространены в газовой форме (водяной пар).
Когда вода находится в твердом состоянии (лед) , молекулы воды упаковываются близко друг к другу, предотвращая ее изменение формы. Лед имеет очень регулярную структуру, в которой молекулы жестко отделены друг от друга и связаны водородными связями, которые образуют кристаллическую решетку. Эти кристаллы имеют несколько открытых областей и карманов, делающих лед менее плотным, чем жидкая вода.Вот почему лед плавает по воде. Лед образуется при температуре ниже нуля (0 ° по Цельсию или 32 ° по Фаренгейту).
Когда лед нагревается выше точки замерзания, он тает и превращается в жидкую воду. В жидкости силы притяжения между молекулами ослабевают, и отдельные молекулы могут начать двигаться друг вокруг друга. Поскольку молекулы могут скользить и скользить друг относительно друга, вода принимает форму любого контейнера, в котором она находится.
Третье состояние воды — это газообразное состояние (водяной пар ).В этом состоянии молекулы воды движутся очень быстро и не связаны друг с другом. Хотя мы не можем видеть воду в газообразном состоянии, мы можем чувствовать ее в воздухе в жаркий влажный день. Обычно вода кипит при температуре 100 ° C (212 ° F), образуя водяной пар. Многие считают, что видимый шлейф пара от кипящего котла — это водяной пар. Однако пар, который вы видите, состоит из очень маленьких капель воды, взвешенных в воздухе, а водяной пар — это невидимый газ, образующийся при испарении воды.Мы можем «видеть» водяной пар через электромагнитные глаза приборов, чувствительных к инфракрасному излучению.
Вода бесконечно циркулирует в атмосфере, океанах, суше и жизни на планете Земля, в то или иное время принимая каждое физическое состояние.
Кредиты
Это мероприятие было разработано в рамках проекта LEARN в UCAR. Он включает графику, созданную программой COMET в UCAR.
Надуйте лучшие пузыри — Scientific American
Ключевые концепции
Химия
Вода
Жидкости
Поверхностное натяжение
Введение
Вы когда-нибудь задумывались, что делает форму пузыря? Секрет создания пузырей — это поверхностное натяжение.Добавление мыла (например, того, которое вы используете для мытья посуды в раковине) в воду, изменяет поверхностное натяжение этой воды, и это создает отличный раствор для образования пузырей.
Если вы попытаетесь сделать пузыри, используя обычную воду, вы быстро увидите, что это не очень хорошо работает. Это связано с тем, что поверхностное натяжение — силы, удерживающие вместе молекулы жидкости — воды слишком велико. Когда моющее средство добавляется в воду, оно снижает поверхностное натяжение, и могут образовываться пузырьки. Добавьте другие ингредиенты, например кукурузный сироп или глицерин, чтобы улучшить пузырьки.Какое решение создаст лучшие пузыри?
Фон
В емкости с водой крошечные молекулы воды притягиваются друг к другу, а это означает, что они постоянно притягиваются друг к другу. На поверхности воды эти молекулы воды притягиваются к молекулам воды вокруг и под ними. Но над ними нет молекул воды, к которым их можно было бы привлечь (поскольку там просто воздух). Это то, что создает силу, известную как поверхностное натяжение.Молекулы воды на поверхности воды не хотят двигаться вверх от других молекул воды, к которым они притягиваются. Это придает простой старой воде высокое поверхностное натяжение. Фактически, он слишком высок, чтобы образоваться большие пузыри.
Когда средство для мытья посуды добавляется в воду, оно снижает поверхностное натяжение, и могут образовываться пузырьки. Молекулы моющего средства увеличивают расстояние между молекулами воды и снижают способность этих молекул взаимодействовать друг с другом. Это уменьшает притяжение или притяжение, которое молекулы воды оказывают друг на друга, снижая поверхностное натяжение раствора.Другие вещества, такие как кукурузный сироп или глицерин, можно добавить в раствор воды и моющего средства, чтобы пузырьки еще лучше.
Материалы
• Три больших чашки или кувшина с широким отверстием
• Мерная чашка на одну чашку
• Дозатор столовой
• Три стакана дистиллированной воды (можно купить в супермаркете)
• Ложка
• Жидкое мыло для мытья посуды (например, марки Dawn или Joy)
• Глицерин, маленькая бутылочка (продается в аптеке или аптеке)
• Легкий кукурузный сироп
• Три устройства для очистки труб
• Перманентный маркер
• Таймер
Подготовка
• Промаркируйте три чашки «Только моющее средство», «Глицерин» и «Кукурузный сироп» соответственно.
• Во все три чашки налейте одну чашку дистиллированной воды.
• В чашку «Только моющее средство» добавьте еще одну столовую ложку воды.
• Сделайте палочку для чистки труб, зажав ее посередине и согнув половину ее в круг, слегка повернув конец, чтобы закрепить. Таким образом сделайте еще две палочки для очистки труб, убедившись, что их диаметры одинаковы.
Процедура
• Во все три чашки добавьте две столовые ложки моющего средства.Смешайте моющее средство ложкой в каждой чашке. При добавлении моющего средства вы должны увидеть, как образуются маленькие пузырьки. Как вы думаете, зачем вам нужны моющие средства в каждом растворе?
• В чашку «Глицерин» добавьте одну столовую ложку глицерина. А в чашку «Кукурузный сироп» добавьте одну столовую ложку кукурузного сиропа. Какая консистенция у глицерина и кукурузного сиропа? Один кажется более вязким (густым и липким), чем другой, или у них примерно такая же вязкость? Смешайте содержимое чашек «Глицерин» и «Кукурузный сироп».
• Надуйте пузырь из одного из растворов (лучше на улице, но над кухонной раковиной или любым другим местом, которое может стать немного липким, это нормально). Постарайтесь поймать пузырек на палочке и рассчитать, сколько времени продержится пузырек, прежде чем он лопнет. Это может быть сложно, поэтому сначала вам, возможно, придется попрактиковаться. Кроме того, может быть полезно, чтобы вас наставил другой человек.
• Выловите и определите время, по крайней мере, для четырех пузырьков из каждого раствора и запишите время. Рассчитайте средний срок службы пузырьков для каждого раствора.Для этого сложите записанное время для каждого типа пузырьков отдельно, затем разделите каждое общее количество на количество записанных вами пузырьков (например, если время пузырьков «Только моющее средство» составляло 5,1 секунды, 4,5 секунды, 5,2 секунды и 5,7 секунды. секунд, среднее значение составит 5,1 секунды). Какое решение делает пузыри дольше всего? Из какого раствора образуются кратчайшие пузыри? Как вы думаете, почему это так? Из одних растворов пузыри были больше, чем из других?
• Extra: Как концентрация глицерина или кукурузного сиропа в растворе пузырьков влияет на продолжительность существования пузырьков? Вы можете попробовать это упражнение еще раз, добавив в растворы разное количество глицерина или кукурузного сиропа. Насколько мало — это мало и сколько слишком много, чтобы добавить? Сможете ли вы приготовить пузырьковый раствор, в результате которого пузырьки будут длиться дольше, чем те, которые использовались в исходной деятельности?
• Extra: Всегда ли пузыри имеют сферическую форму? Попробуйте скрутить очистители труб в разные формы, например звезды, квадраты или треугольники. Какую форму имеют пузыри, образованные этими палочками для очистки труб разной формы?
Наблюдения и результаты
Выделяли ли растворы с глицерином или кукурузным сиропом более продолжительные пузыри? Образовал ли раствор с глицерином самые продолжительные пузыри из всех?
Моющее средство снижает поверхностное натяжение воды настолько, что могут образовываться пузырьки.Пузырь, образованный из раствора с водой и моющим средством, представляет собой сферический слой молекул воды, окруженный с обеих сторон слоем молекул моющего средства. Части молекул моющего средства притягиваются к воде (что означает, что они известны как гидрофильные), а другие части не хотят находиться рядом с водой (они гидрофобны). Из-за этого молекулы моющего средства в пузырьке ориентируются так, что их гидрофильные части соприкасаются с водой, а их гидрофобные части обращены наружу, касаясь воздуха.
Раствор, содержащий только воду и моющее средство, вероятно, давал более мелкие и более короткоживущие пузырьки по сравнению с растворами с глицерином или кукурузным сиропом. Пузырьки лопаются, когда слой молекул воды между молекулами моющего средства испаряется. Но глицерин и кукурузный сироп образуют слабые связи с молекулами воды и замедляют процесс испарения, тем самым увеличивая срок службы и долговечность пузыря. Глицерин образует более сильные и долговечные пузырьки, но кукурузный сироп часто заменяют пузырьковыми растворами, потому что он дешевле.Можете ли вы найти в доме другие вещества, которые можно добавить в воду для образования пузырьков? Если вы попробуете такие продукты, как шампунь или жидкое мыло для рук, вы можете проверить их состав, чтобы увидеть, что может способствовать образованию пузырьков.
Больше для изучения
«Лопающиеся пузыри порождают крошечные пузыри» от Scientific American
«Пузыри» от Роба Хипшмана в Exploratorium.
«Мыльные пузыри» из Новости химии и машиностроения
«Пузыри без мыла» от NASA’s Saturday Morning Science
«Пузырьковая логика» от Science Buddies
Это занятие предоставлено вам в партнерстве с Science Buddies
Химические реакции и молекулы | Биология для майоров I
Результаты обучения
- Определите компоненты простых химических реакций
Все элементы наиболее стабильны, когда их внешняя оболочка заполнена электронами в соответствии с правилом октетов.Это потому, что атомам энергетически выгодно находиться в такой конфигурации, и это делает их стабильными. Однако, поскольку не все элементы имеют достаточно электронов, чтобы заполнить свои внешние оболочки, атомы образуют химических связей, с другими атомами, тем самым получая электроны, необходимые для достижения стабильной электронной конфигурации. Когда два или более атома химически связаны друг с другом, результирующая химическая структура представляет собой молекулу. Знакомая молекула воды H 2 O состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе с образованием воды, как показано на рисунке 1.Атомы могут образовывать молекулы, отдавая, принимая или деля электроны для заполнения своих внешних оболочек.
Рис. 1. Два или более атома могут связываться друг с другом, образуя молекулу. Когда два атома водорода и кислород обмениваются электронами через ковалентные связи, образуется молекула воды.
Химические реакции происходят, когда два или более атома соединяются вместе, образуя молекулы, или когда связанные атомы разрываются. Вещества, используемые в начале химической реакции, называются реагентами (обычно находятся в левой части химического уравнения), а вещества, обнаруженные в конце реакции, известны как продукты (обычно встречаются на правая часть химического уравнения).Стрелка обычно проводится между реагентами и продуктами, чтобы указать направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для создания молекулы воды, показанной выше, химическое уравнение будет:
2Н + О → Н 2 О
Пример простой химической реакции — разрушение молекул перекиси водорода, каждая из которых состоит из двух атомов водорода, связанных с двумя атомами кислорода (H 2 O 2 ).Реагирующая перекись водорода распадается на воду, содержащую один атом кислорода, связанный с двумя атомами водорода (H 2 O), и кислород, который состоит из двух связанных атомов кислорода (O 2 ). В приведенном ниже уравнении реакция включает две молекулы перекиси водорода и две молекулы воды. Это пример сбалансированного химического уравнения , в котором количество атомов каждого элемента одинаково на каждой стороне уравнения. Согласно закону сохранения материи, количество атомов до и после химической реакции должно быть одинаковым, чтобы при нормальных обстоятельствах ни один атом не создавался или не разрушался.
2H 2 O 2 (перекись водорода) → 2H 2 O (вода) + O 2 (кислород)
Хотя все реагенты и продукты этой реакции являются молекулами (каждый атом остается связанным по крайней мере с одним другим атомом), в этой реакции только перекись водорода и вода представляют подкласс молекул, известный как соединения : они содержат атомы более чем одного типа элементов. С другой стороны, молекулярный кислород, как показано на рисунке 2, состоит из двух атомов кислорода с двойной связью и классифицируется не как соединение, а как элемент.
Рис. 2. Атомы кислорода в молекуле O 2 соединены двойной связью.
Некоторые химические реакции, такие как показанная выше, могут протекать в одном направлении до тех пор, пока не будут израсходованы все реагенты. Уравнения, описывающие эти реакции, содержат однонаправленную стрелку и являются необратимыми . Обратимые реакции — это реакции, которые могут идти в любом направлении. В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для конкретной реакции), некоторые из этих продуктов снова превращаются в реагенты; на этом этапе обозначения продуктов и реагентов меняются местами.Это продолжается до тех пор, пока не будет достигнут определенный относительный баланс между реагентами и продуктами — состояние, называемое равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двойной стрелкой, указывающей как на реагенты, так и на продукты.
Например, в крови человека избыточные ионы водорода (H + ) связываются с ионами бикарбоната (HCO 3 — ), образуя состояние равновесия с угольной кислотой (H 2 CO 3 ).Если в эту систему добавить угольную кислоту, часть ее превратится в ионы бикарбоната и водорода.
HCO 3 — + H + ↔ H 2 CO 3
В биологических реакциях, однако, равновесие достигается редко, потому что концентрации реагентов или продуктов, или того и другого, постоянно меняются, часто при этом продукт одной реакции становится реагентом для другой. Возвращаясь к примеру с избытком ионов водорода в крови, образование угольной кислоты будет основным направлением реакции.Однако угольная кислота может также покидать тело в виде углекислого газа (при выдохе) вместо того, чтобы превращаться обратно в бикарбонат-ион, тем самым направляя реакцию вправо по химическому закону, известному как закон действия масс . Эти реакции важны для поддержания гомеостаза нашей крови.
HCO 3 — + H + ↔ H 2 CO 3 CO 2 + H 2 O
Резюме: химические реакции и молекулы
Внешняя электронная оболочка определяет, насколько легко и какого типа химические связи образует конкретный атом.Образование соединений часто визуально описывается химическими уравнениями, которые показывают, что реагенты участвуют в химических реакциях с образованием продуктов.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.

 Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,
Таким образом, второй результат работы — измерение распределения OH-потенциалов в сети постоянно изменяющихся водородных связей. На следующем этапе исследований необходимо выяснить, возможно ли из спектров резонансного неупругого рассеяния воды определить такой важный структурный параметр, как среднее число связей молекулы. Он определяет энергию взаимодействия последней с её окружением, а значит, и такие свойства, как скорость звука в воде и её теплоёмкость»,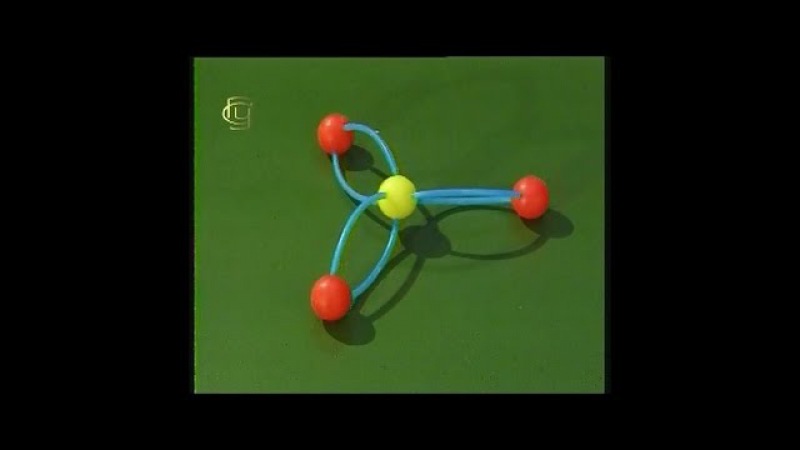 В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.
В процессе диссоциации возбуждённая молекула возвращается в основное (0) или конечное состояние (f) испуская другой фотон и формируя спектр вблизи 535 эВ и 526 эВ, соответственно.